Leśniak Lucyna 11.01.2001
Grupa 24
Mieszaniny cieczy o ograniczonej rozpuszczalności
Jeżeli dwie ciecze A i B mają ograniczoną rozpuszczalność, to przy określonym stosunku ilościowym obu cieczy następuje rozdzielenie mieszaniny na dwie fazy. Jedna z nich jest nasyconym roztworem cieczy A w cieczy B, druga zaś nasyconym roztworem cieczy B w cieczy A. (rys.1).
Wzajemna rozpuszczalność obu cieczy praktycznie nie zależy od ciśnienia, natomiast zmienia się z temperaturą. W tabeli podano wzajemną rozpuszczalność wody i fenolu w różnych temperaturach. Widzimy, że zarówno rozpuszczalność fenolu w wodzie (faza I), jak i wody w fenolu (faza II) wzrasta wraz ze wzrostem temperatury i w temperaturze 341,8 K skład obu faz staje się identyczny.
Temperatura [K] |
Faza I nasycony roztwór fenolu w wodzie |
Faza II nasycony roztwór wody w fenolu (% wody) |
|
|
% wody |
% fenolu |
|
293 |
91,60 |
8,40 |
27,76 |
303 |
91,08 |
8,92 |
30,05 |
313 |
90,22 |
9,78 |
33,19 |
323 |
87,92 |
12,08 |
37,17 |
333 |
82,90 |
17,10 |
43,90 |
338 |
77,74 |
22,26 |
50,66 |
341,8 |
64,10 |
35,90 |
64,10 |
Jeżeli na osie odciętych odłożymy skład mieszaniny wyrażonej w procentach masowych wody, a na osi rzędnych temperaturę, to otrzymamy krzywą o kształcie paraboli przedstawioną na rysynku 2.
rys 2. Krzywa równowagi faz ciekłych w układzie fenol - woda
Odcinek AB jest krzywą rozpuszczania wody w fenolu, odcinek BC krzywą rozpuszczania fenolu w wodzie. Krzywa dzieli płaszczyznę rysunku na cztery pola. Pole 1 odpowiada nienasyconemu roztworoiwi fenolu w wodzie, pole 2 nienasyconemu roztworowi wody w fenolu, pole 3 - układowi o dwóch fazach ciekłych, których skład zmienia się wraz z temperaturą.
Punkt B nazywamy punktem krytycznym rozpuszczalności. Powyżej tego punktu (w naszym przykładzie powyżej 341,8 K) obie fazystają się identyczne zarówno pod względem składu jak i właściwości fizycznych. Wzajemna rozpuszczalność obu cieczy staje się nieograniczona i układ niezależnie od składu tworzy jednolitą fazę ciekłą. Pole 4 odpowiada takiemu właśnie jednolitemu układowi jednofazowemu.
Mieszanina cieczy fenol - woda jest najczęściej spotykanym przypadkiem kiedy występuje jeden krytyczny punkt rozpuszczalnośći będący maksymalną temperaturą współistnienia dwóch faz (rys. 3).
rys.3 Analiza ilościowa równowagi fazowej ciecz - cziecz dla dwu cieczy o ograniczonej mieszalności
Niech stan układu charakteryzuje punkt a; znajduje się on w obszarze dwufazowym. Skład powstających dwu faz znajdziemy prowadząc przez punkt a prostą równoległą do osi składu. Prosta ta przetnie się z krzywą równowagi w punktach b i c, które określają skład obu faz. Z diagramu można odczytać stosunek ciężarów obu faz. Ma tutaj zastosowanie reguła dźwigni dwuramiennej. Jeżeli fazą ciekłą będącą nasyconym roztworem składnika B w składniku A oznaczymy przez , a fazę ciekłą będącą nasyconym roztworem A w B przez to stosunek mas obu faz:
![]()
przy czym ac i bc przypominają nam długości ramion dźwigni, na których końcu zawieszone są odpowiednie fazy.
Uzasadnienie reguły dźwigni:
m- całkowita masa układu
m- masa fazy
m- masa fazy
m⋅xA- całkowita masa substancji A w układzie, gdzie xA jest ułamkiem masowym składnika A w całym układzie
m⋅xA- masa substancji A w fazie
m⋅xA- masa substancji A w fazie
zatem:
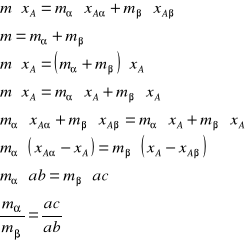
Reguła dźwigni ma powszechne zastosowanie w analizie różnych diagramów fazowych i oddaje nieocenione usługi przy ustaleniu proporcji różnych faz będących w równowadze.
Podwyższając temperaturę przechodzimy od stanu a, a' i a'' do punktu K. Skład faz ulega przy tym zmianie ze względu na wzrost wzajemnej rozpuszczalności. Skład fazy zmienia się wzdłuż lewej gałęzi krzywej poprzez punkty b' i b'', natomiast skład fazy wzdłuż prawej gałęzi krzywej poprzez punkty c' i c''. Zmieniają się również proporcje obu faz; podczas podgrzewania ilość fazy zmniejsza się na korzyść fazy ponieważ zwiększa się stosunek odcinków
![]()
W punkcie K faza zanika w ogóle, powyżej tego punktu wkraczamy w obszar jednofazowy. Podobną analizę można przeprowadzić dla dowolnego diagramu dwufazowego równowag ciecz - ciecz np. takiego jak na rysunkach poniżej.
rys 4. Inne charakterystyczne diagramy rozpuszczalności dwóch cieczy o ograniczonej rozpuszczalności
Mieszanina nikotyna - woda ma 2 punkty krytyczne: górny i dolny. Obszar układów dwufazowych jest ograniczony w tym przypadku krzywą zamkniętą przedstawioną na rysunku 4b. Znane są ciecze, których wzajemna rozpuszczalność wzrasta z obniżeniem temperatury. Przykładem może być mieszanina trietyloaminy i wody, która ma dolną temperaturę krytyczną mieszania (rys. 4a).
Wyszukiwarka
Podobne podstrony:
borowik, Politechnika Wrocławska, W11 - PPT
9401, Politechnika Wrocławska, W11 - PPT
będziński, Politechnika Wrocławska, W11 - PPT
7146, Politechnika Wrocławska, W11 - PPT
8544, Politechnika Wrocławska, W11 - PPT
podbielska, Politechnika Wrocławska, W11 - PPT
6227, Politechnika Wrocławska, W11 - PPT
borowik, Politechnika Wrocławska, W11 - PPT
1352, Politechnika Wrocławska, W11 - PPT
juroszek, Politechnika Wrocławska, W11 - PPT
5189, Politechnika Wrocławska, W11 - PPT
7032, Politechnika Wrocławska, W11 - PPT
8741, Politechnika Wrocławska, W11 - PPT
Zadania-lista4, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
więcej podobnych podstron