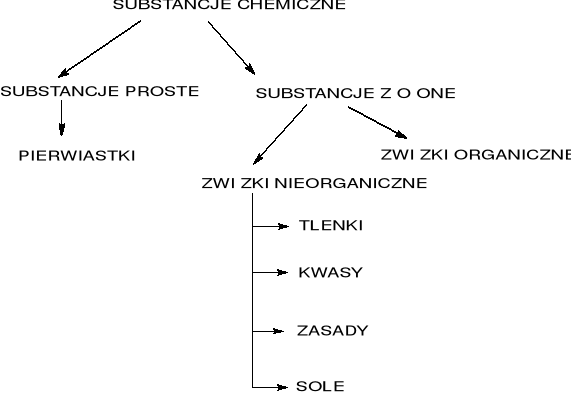
TLENKI
TLENKI: związki pierwiastków z tlenem o ogólnym wzorze:
EnOm
E - dowolny pierwiastek, n, m - współczynniki, tlen zawsze na _ II stopniu utlenienia.
Wzór tlenku |
Nazwa obowiązująca
|
H2O |
- |
K2O |
tlenek potasu |
N2O |
tlenek azotu (I) |
NO |
tlenek azotu (II) |
N2O3 |
tlenek azotu (III) |
NO2 |
tlenek azotu (IV) |
N2O5 |
tlenek azotu (V) |
Al2O3 |
tlenek glinu |
CaO |
tlenek wapnia |
CuO |
tlenek miedzi (II) |
CrO |
tlenek chromu (II) |
Cr2O3 |
tlenek chromu (III) |
CrO3 |
tlenek chromu (VI) |
FeO |
tlenek żelaza (II) |
Fe2O3 |
tlenek żelaza (III) |
CO |
tlenek węgla (II) |
CO2 |
tlenek węgla (IV) |
WODORKI
WODORKI: związki pierwiastków z wodorem o wzorze
EHn i HnE (dla pierwiastków grup 16 i 17 układu okresowego)
Wzór sumaryczny wodorku |
Nazwa dopuszczalna |
Nazwa obowiązująca (systematyczna) |
KH |
Wodorek potasu |
wodorek potasu |
NaH |
Wodorek sodu |
wodorek sodu |
CaH2 |
Wodorek wapnia |
wodorek wapnia |
AlH3 |
Wodorek glinu |
wodorek glinu |
SiH4 |
Silan |
silan |
NH3 |
Amoniak |
azan |
H3N |
azydek wodoru |
azydek wodoru |
PH3 |
fosfina |
fosfan |
AsH3 |
arsyna |
arsan |
H2S |
siarkowodór |
sulfan |
H2Se |
selenowodór |
selan |
HF |
fluorowodór |
fluorek wodoru |
HCl |
chlorowodór |
chlorek wodoru |
HBr |
bromowodór |
bromek wodoru |
HI |
jodowodór |
jodek wodoru |
KWASY
KWASY: związki o wzorze ogólnym:
HnR
gdzie: H - wodór, R - reszta kwasowa, n - wartościowość reszty kwasowej
Wzór sumaryczny kwasu |
Nazwa obowiązującą
|
Wzór anionu |
Nazwa anionu |
HF |
kwas fluorowodorowy |
F─ |
fluorek |
HCl |
kwas solny |
Cl─ |
chlorek |
HBr |
kwas bromowodorowy |
Br─ |
bromek |
HI |
kwas bromowodorowy |
I─ |
jodek |
H2S |
kwas siarkowodorowy |
S2─ |
siarczek |
HCN |
kwas cyjanowodorowy |
CN─ |
cyjanek |
HClO |
kwas chlorowy (I) |
ClO─ |
chloran (I) |
HClO2 |
kwas chlorowy (III) |
ClO2─ |
chloran (III) |
HClO3 |
kwas chlorowy (V) |
ClO3─ |
chloran (V) |
HClO4 |
kwas chlorowy (VII) |
ClO4─ |
chloran (VII) |
H3PO4 |
kwas ortofosforowy (V) |
PO43─ |
ortofosforan (V) |
H2SO3 |
kwas siarkowy (IV) |
SO32─ |
siarczan (IV) |
H2SO4 |
kwas siarkowy (VI) |
SO42─ |
siarczan (VI) |
H2S2O3 |
kwas tiosiarkowy |
S2O32─ |
tiosiarczan |
H2CO3 |
kwas węglowy |
CO32─ |
węglan |
H2SiO3 |
kwas krzemowy |
SiO32─ |
krzemian |
HNO2 |
kwas azotowy (III) |
NO2─ |
azotan (III) |
HNO3 |
kwas azotowy (V) |
NO3─ |
azotan (V) |
H2MnO4 |
kwas manganowy (VI) |
MnO42─ |
manganian (VI) |
HMnO4 |
kwas manganowy (VII) |
MnO4─ |
manganian (VII) |
H2CrO4 |
kwas chromowy (VI) |
CrO42─ |
chromian (VI) |
WODOROTLENKI
WODOROTLENKI: związki o ogólnym wzorze:
E(OH)n
gdzie: E - pierwiastek; OH - grupa wodorotlenowa jednoujemna, n - ilość grup wodorotlenowych = wartościowość kationu
Wyjątki: kationy: amonowy NH4+
Wzór wodorotlenku |
Nazwa obowiązująca
|
KOH |
wodorotlenek potasu |
NaOH |
wodorotlenek sodu |
Ca(OH)2 |
wodorotlenek wapnia |
Al(OH)3 |
wodorotlenek glinu |
CuOH |
wodorotlenek miedzi (I) |
Fe(OH) 2 |
wodorotlenek żelaza (II) |
Fe(OH)3 |
wodorotlenek żelaza (III) |
Zn(OH)2 |
wodorotlenek cynku (II) |
Cr(OH)2 |
wodorotlenek chromu (II) |
Cr(OH)3 |
wodorotlenek chromu (III) |
Pb(OH)4 |
wodorotlenek ołowiu (IV) |
NH4OH |
wodorotlenek amonu |
SOLE
SOLE: związki chemiczne powstałe w wyniku reakcji zobojętnia wodorotlenków
kwasami tlenowymi i beztlenowymi o ogólnym wzorze:
EnRm
gdzie: nEm+ - kation pierwiastka zasadotwórczego lub kation złożony
m Rn- - reszta kwasowa; n, m współczynniki.
SOLE KWASÓW BEZTLENOWYCH
Wzór soli |
Nazwa obowiązująca
|
FeCl2 |
chlorek żelaza(II) |
FeCl3 |
chlorek żelaza(III) |
CaF2 |
fluorek wapnia(II) |
SnCl4 |
chlorek cyny(IV) |
KJ |
jodek potasu |
KCN |
cyjanek potasu |
Ag2S |
siarczek srebra(I) |
(NH4)2S |
siarczek amonu |
SOLE KWASÓW TLENOWYCH
Wzór soli |
Nazwa obowiązująca
|
Fe(ClO2)2 |
chloran(III) żelaza(II) |
Fe(ClO3)3 |
chloran(V) żelaza(III) |
Sn(ClO4)4 |
chloran(VII) cyny (IV) |
Ag2SO4 |
siarczan(VI) srebra(I) |
(NH4)2SO3 |
siarczan(IV) amonu |
Al(NO3) 3 |
azotan(V) glinu |
Na2CO3 |
węglan sodu
|
KMnO4 |
manganian(VII) potasu |
K2CrO4 |
chromian(VI) potasu |
Związki koordynacyjne
Wzory jonów kompleksowych
We wzorach jonów kompleksowych podaje się symbol atomu centralnego (koordynującego), a następnie symbole ligandów. Wzór jonu podaje się w nawiasie kwadratowym, w prawym górnym indeksie podając ładunek, jeśli wypadkowy ładunek jest różny od zera.
Np.: [Fe(CN)6]4-,
[AgCl2]-,
[Cu(NH3)4]2+,
[Cr(C6H6)2],
[PtCl2(NH3)2]
Ligandy są zapisywane w kolejności alfabetycznej symboli atomów, związanych z atomem centralnym. Jeśli są to rozpoczynające się od tej samej litery, decyduje kolejność nazw ligandów (np. „chloro” - Cl przed „cyjano” - CN).
Nazwy związków kompleksowych
Jeśli jon kompleksowy jest anionem, to obowiązuje podobna zasada jak przy nazwach anionów złożonych - do nazwy jonu centralnego dodaje się końcówkę „-an”, czyli np. rtęcian, niklan, ale z uwzględnieniem polskich zasad językowych - srebrzan (a nie srebran) czy żelazian (a nie żelazan).
Jeśli jon kompleksowy jest kationem, albo posiada wypadkowy ładunek zerowy - końcówki nie dodajemy i nazwa atomu centralnego się nie zmienia.
Nazwy ligandów:
Jeśli ligand jest anionem - w większości przypadków obowiazuje końcówka
„-o”, podobnie jak w językach zachodnich. Jeśli ligand nie ma ładunku, nie stosujemy tej końcówki, ale nazwa jest podawana z rdzeniem łacińskim i stąd może się różnić od nazwy jonu nieskoordynowanego lub cząsteczki. Typowe przykłady podano w Tabeli 3. Dla grupy NH3 stosujemy np. nazwę „amina”.
Nazwy najczęściej spotykanych ligandów
Wzór |
Nazwa jonu/cząsteczki |
Nazwa ligandu |
F- Cl- I- O2- H- HO- S2- HS- CN- CH3O- CH3COO- S2O32- H2O NH3 CO |
fluorek chlorek jodek tlenek wodorek wodorotlenek siarczek wodorosiarczek cyjanek metoksyd octan tiosiarczan woda amoniak karbonyl (grupa)
|
fluoro chloro jodo okso hydrydo / hydro hydrokso tio merkapto cyjano metokso octano tiosiarczano akwa amina karbonyl
|
Ponieważ nazwa ma odzwierciedlać strukturę, nazwa jonu kompleksowego rozpoczyna się od przedrostka liczebnikowego greckiego, określającego liczbę ligandów. Dla przypadków złożonych, stosuje się przedrostki złożone: bis, tris, itp. Następnie podaje się nazwę atomu centralnego (z końcówką „-an” dla anionu lub bez końcówki, jeśli jon nie jest anionem). Ładunek jonu (atomu) centralnego wyrażamy cyfrą rzymską w nawiasie okrągłym - systemie Stocka.
Czyli nazwy poprzednio podanych jonów brzmiałyby:
[Fe(CN)6]4- heksacyjanożelazian(II)
[AgCl2]-, dichlorosrebrzan(I)
[Cu(NH3)4]2+ tetraaminamiedź(II)
[Cr(C6H6)2] bis(benzen)chrom(0)
[PtCl2(NH3)2] diaminadichloroplatyna(II)
Nazwy związków koordynacyjnych podaje się według ogólnych zasad dla związków nieorganicznych, czyli
1/ jeśli jon jest anionem, to rozpoczyna on nazwę związku, np.:
K4[Fe(CN)6] - heksacyjanożelazian(II) potasu
2/ jeśli jon kompleksowy jest kationem, wówczas w nazwie
związku znajduje się na miejscu drugim, np:
[Co(NH3)6]Cl3 chlorek heksaaminakobaltu(III)
WYKŁAD Z CHEMII
dr Beata Dasiewicz
Nowoursynowska 159C, budynek 032 (zielony), pok. 2061
tel. sł.: (0 22) 593 76 25, mail: beata_dasiewicz@sggw.pl
konsultacje: czwartek 12.15 -13.45
Wyszukiwarka
Podobne podstrony:
10.Nazewnictwo, Notatki AWF, Biochemia
NAZEWNICTWO I DEFINICJE DOTYCZĄCE PROBLEMATYKI BIOMATERIAŁÓW, biomateriały
139 ROZ oznaczenia i nazewnictwo w decyzji lokalizacji
Nazewnictwo i wzory zasad, Inżynieria środowiska ZUT, Chemia
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Nazewnictwo i wzory soli - gimnazjum, chemia gimnazjum
Nazewnictwo i podział tlenków, Liceum, testy
Nazewnictwo soli
NAZEWNICTWO W PROCESIE TERMICZNEGO PRZETWARZANIA ODPADÓW
Nazewnictwo i met otrz zw nieorganicznych
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
Nazewnictwo okresu historycznoliterackiego 2 poł XIX wieku
nazewnictwo 2 id 315941 Nieznany
krwotok i krwawienie podstawowe nazewnictwo i róznicowanie
Nazewnictwo INCI i CTFA
Nazewnictwo łacińskie tabelki
Co zmieniło się w nazewnictwie w MSR 1, Licencjat UE, sprawozdawczość finansowa
więcej podobnych podstron