WRZENIE I KRZEPNIĘCIE ROZTWORÓW
Roztwory substancji mają inne temperatury wrzenia i krzepnięcia niż czyste rozpuszczalniki.
Substancje mało lotne (ciecze o wysokich temperaturach wrzenia lub ciała stałe) podwyższają temperaturę wrzenia i obniżają temperaturę krzepnięcia roztworu w stosunku do czystego rozpuszczalnika.
Substancje łatwo lotne (ciecze o niskich temperaturach wrzenia) obniżają temperaturę wrzenia roztworu w stosunku do czystego rozpuszczalnika.
Ponieważ wrzenie cieczy jest związane z ciśnieniem pary nasyconej nad tą cieczą to można wnioskować, że ciśnienie pary nasyconej zależy od stężenia roztworu.
Mówi o tym prawo Raoulta:
Prężnością pary nazywa się ciśnienie jakie w danej temperaturze
wywiera para nasycona.
Dla układu dwuskładnikowego prężność pary nad roztworem będzie równa:
p = p1 + p2
a ponieważ:
p1 = x1 ⋅ p1o p2 = x2 ⋅ p2o x1 + x2 = 1
p = x1 ⋅ p1o + x2 ⋅ p2o = p1o (1-x2) + p2o ⋅ x2
czyli, że
prężność pary nad roztworem jest liniową funkcją składu roztworu.
T = const
p
p2o p1 - nad czystą substancją A
(np. rozpuszczalnik)
p2 - nad czystą substancją B
(np. substancja rozpuszczona)
p1o p2
p1
100% A 100% B
0% B 0%A
xB → ← xA
W przypadku, gdy substancja rozpuszczona jest nielotna, tzn.
p2o = 0
powyższa zależność wynosi:
p = p1 = p1o ⋅ x1 = p1o (1-x2)
Czyli:
Prawo Raoulta stosuje się ściśle tylko do roztworów doskonałych, w których nie ma oddziaływań pomiędzy składnikami. W roztworach rzeczywistych występują odchylenia od tego prawa, które mogą mieć różny charakter.
• ODCHYLENIA UJEMNE
jeżeli: fA-A ~ fB-B < fA-B → ciśnienie pary nasyconej nad roztworem będzie niższe niż to przewiduje prawo Raoulta , bo: cząsteczki chętnie przebywają w roztworze i trudniej przechodzą do fazy gazowej.
• ODCHYLENIA DODATNIE
jeżeli: fA-A ~ fB-B > fA-B → ciśnienie pary nasyconej nad roztworem będzie wyższe niż to przewiduje prawo Raoulta, bo: cząsteczki łatwiej będą przechodzić do fazy gazowej.
Roztwory, które wykazują minimum lub maksimum na krzywej ciśnienia pary nasyconej (lub na krzywej temperatury wrzenia) nazywa się azeotropami. Te roztwory, które nie wykazują tej cechy - nazywa się zeotropami.
Prawo Raoulta dla roztworów substancji nielotnych:
pAo - ciśnienie pary nasyconej rozpuszczalnika nad samym
rozpuszczalnikiem
xA - ułamek molowy rozpuszczalnika w roztworze
pA - ciśnienie pary nasyconej rozpuszczalnika nad roztworem
Ponieważ XA + XB = 1 to
ułamek molowy
substancji nielotnej w roztworze
EBULIOMETRIA
Zmiana ciśnienia pary nad roztworem wiąże się z podwyższeniem lub obniżeniem jego temperatury wrzenia i krzepnięcia w stosunku do tych temperatur dla czystego rozpuszczalnika.
Zmiana ta wyraża się zależnością:
stężenie wyrażone w ilości moli
substancji rozpuszczonej w 1 kg
m` = n / mrozp rozpuszczalnika (tzw. molalność)
n = m / M
masa substancji rozpuszczonej [kg] masa molowa substancji rozpuszczonej
Dla: m = M oraz mrozp = 1 kg
Stała ebulioskopowa równa jest zmianie
temperatury wrzenia roztworu zawierającego 1 mol substancji rozpuszczonej w 1 kg rozpuszczalnika w stosunku do temperatury wrzenia czystego rozpuszczalnika. Jest to wielkość charakterystyczna dla rozpuszczalnika i nie zależy od rodzaju substancji rozpuszczonej.
KRIOMETRIA
Roztwory substancji nielotnych mają inne, niż czyste rozpuszczalniki, temperatury krzepnięcia. Zmianę temperatury krzepnięcia roztworu w zależności od jego stężenia wyraża zależność:
zmiana temperatury krzepnięcia roztworu
stała krioskopowa rozpuszczalnika molalność
Analogicznie, jak dla ΔTwrz można napisać:
Stała krioskopowa, charakterystyczna dla danego rozpuszczalnika, jest równa zmianie temperatury krzepnięcia roztworu, gdy w 1 kg rozpuszczalnika rozpuszczony jest 1 mol nielotnej substancji.
Na podstawie Δ Twrz i Δ Tkr wyznacza się masy molowe substancji rozpuszczonych w roztworach.
RÓWNOWAGI CIECZ-PARA DLA UKŁADÓW DWUSKŁADNIKOWYCH
Poprzednio pokazano na wykresach zależność ciśnienia pary nasyconej od składu roztworu ciekłego. Dla wielu zastosowań ważne jest przedstawienie zależności ciśnienia pary nasyconej zarówno od składu cieczy, jak i składu pary nad tą cieczą, gdyż skład pary będącej w równowadze z cieczą dla układu dwuskładnikowego jest na ogół inny niż skład cieczy.
Skład pary można wyrazić za pomocą ułamków molowych, jako:
pA
xA(para) = --------------
pA + pB
pA , pB - ciśnienia cząstkowe składników A i B w parze nad cieczą będącą
roztworem A i B.
Z prawa Raoulta → pA = xA (ciecz) ⋅ pAo pB = xB (ciecz) ⋅ pBo
Zatem:
Wzory podają, zależność
między składem pary i
składem cieczy dla układu
dwuskładnikowego
znajdującego się w stanie
równowagi.
Po podzieleniu stronami:
pAo ≠ pBo
Wzór ten pozwala obliczyć skład pary w równowadze z roztworem doskonałym o dowolnym składzie.
Zależność ciśnienia pary nasyconej lub temperatury od składu pary i składu roztworu (cieczy) przedstawia się następującymi wykresami:
T = const
p Krzywa górna - zależność ciśnienia pary
nasyconej od składu cieczy;
ciecz Krzywa dolna - zależność ciśnienia pary
pB nasyconej od składu pary;
Obszar środkowy = współistnienie cieczy
współistnienie i pary w równowadze
cieczy i pary
pA
para
A B
XB →
p = const
T Krzywa górna - zależność temperatury
wrzenia roztworu od składu pary;
para Krzywa dolna - zależność temperatury
TwA wrzenia roztworu od składu cieczy;
współistnienie
cieczy i pary Obszar środkowy = współistnienie cieczy
i pary w równowadze
ciecz TwB
A B
XB →
Wykresy te powstały przez nałożenie na siebie dwu wykresów: zależności prężności pary nad roztworem od składu roztworu i wykresu składu pary nasyconej nad roztworem w zależności od jej prężności.
Wykresy te odnoszą się do układów homozeotropowych (bez minimum czy maksimum na krzywej prężności pary w funkcji składu roztworu) o nieograniczonej mieszalności w fazie ciekłej.
Proces przeprowadzania cieczy w stan pary i następnie skroplenie tej pary nazywa się destylacją. Ponieważ para nad roztworem jest w stosunku do roztworu zawsze bogatsza w składnik bardziej lotny, destylacja jest wykorzystywana jako najprostszy sposób oczyszczania cieczy; szczególnie dobre efekty osiąga się dla mieszanin cieczy znacznie różniących się temperaturami wrzenia.
Dla cieczy (roztworu) o składzie określonym punktem C prężność pary odczytana z krzywej prężności pary (niebieska) wynosi pc, dla tego punktu skład pary odczytuje się z krzywej zależności składu pary od prężności (czerwona) - punkt P → para nad roztworem jest bogatsza w składnik bardziej lotny.
T=const
p=const
Roztwór o składzie C wrze w temperaturze Tw , a para nad nim ma skład P.
Po skropleniu tej pary otrzymuje się ciecz znacznie wzbogaconą w lotniejszy składnik B. Przeprowadzenie roztworu o składzie P w stan pary spowoduje, że para ta będzie zawierała jeszcze więcej tego składnika, a ciecz powstała po jej skropleniu będzie prawie czystym składnikiem B. Powtórzenie tego procesu doprowadzi do zupełnego oddzielenia składnika B od trudniej lotnego składnika A, który pozostanie w naczyniu destylacyjnym.
Wielokrotne powtórzenie procesu destylacji nazywane destylacją frakcyjną - rektyfikacją, może się odbywać w sposób ciągły z zastosowaniem kolumny destylacyjnej w laboratorium lub kolumn rektyfikacyjnych w skali przemysłowej, w których wielokrotnie skrapla się i odparowuje destylat. Jeden cykl parowania-skraplania nazywa się półką teoretyczną. Liczba półek teoretycznych jest proporcjonalna do długości kolumny - dla dobrego rozdziału wskazana jest większa liczba półek,
czyli dłuższa kolumna.
Aby uniknąć rozkładu substancji w temperaturze wrzenia obniża się tę temperaturę poprzez prowadzenie destylacji pod zmniejszonym ciśnieniem.
Oddziaływania pomiędzy cząsteczkami w roztworach rzeczywistych powodują, że zależność prężności pary od składu cieczy i od składu pary wykazuje ekstremum (minimum lub maksimum) - roztwory te są azeotropami.
Przykłady mieszanin azeotropowych:
aceton -chloroform, kwas siarkowy-woda, roztwory wodne fluorowcowodorów (HCl, HBr) (odchylenia ujemne-maksimum temperatury wrzenia i minimum na krzywej prężności pary nad roztworem);
etanol-woda, metanol-aceton, chloroform-etanol (odchylenia dodatnie-minimum temperatury wrzenia i maksimum na krzywej prężności pary nad roztworem).
Na przykład: zupełne rozdzielenie mieszaniny azeotropowej etanol-woda
(~4,7 % wody) można uzyskać stosując substancje wiążące wodę (np. wapno palone) lub dodając do układu trzeci składnik, np. benzen. Ten składnik tworzy z pozostałymi azeotrop trójskładnikowy, który oddestylowuje jako pierwszy (w temperaturze 64,9°C) i tym samym wiąże wodę z układu. Pozostały roztwór etanolu z benzenem tworzy azeotrop dwuskładnikowy, który z kolei rozdziela się na czysty etanol i azeotrop etanol-benzen. Ten ponownie miesza się z azeotropem etanol-woda w celu utworzenia azeotropu trójskładnikowego i proces powtarza się otrzymując kolejne porcje czystego etanolu. Tak otrzymany 100% etanol nie nadaje się do celów spożywczych, gdyż może zawierać śladowe ilości bardzo toksycznego benzenu w postaci azeotropu benzen-etanol. Skład azeotropu etanol-woda można nieznacznie zmieniać stosując zwiększone ciśnienie, ale ten sposób nie jest stosowany do otrzymywania 100% etanolu.
Układ dwu cieczy o ograniczonej rozpuszczalności wzajemnej nie wykazujący maksimum czy minimum ciśnienia pary (lub temperatury wrzenia) nazywa się układem heterozeotropowym (np. woda-kwas salicylowy, woda-kwas benzoesowy). Wzajemną rozpuszczalność tych substancji można zwiększyć poprzez zwiększenie temperatury i ciśnienia,
a układ może przejść w układ homozeotropowy.
Układy cieczy o ograniczonej rozpuszczalności wzajemnej ale wykazujące ekstremum temperatury wrzenia (lub ciśnienia pary) nazywa się układami heteroazeotropowymi (np. woda-anilina, woda-butanol).
Sumaryczne ciśnienie pary nad takimi cieczami w roztworze jest równe sumie ciśnień pary nad poszczególnymi cieczami składowymi:
p = pAo + pBo
a cząstkowe prężności każdego składnika nie zależą od jego stężenia.
p
całkowita prężność pary
prężność składnika B
prężność składnika A temperatura wrzenia
0% A skład 100%A 0% A skład 100%A
100%B 0%B 100%B 0%B
Fakt ten jest wykorzystywany w procesie destylacji z parą wodną,
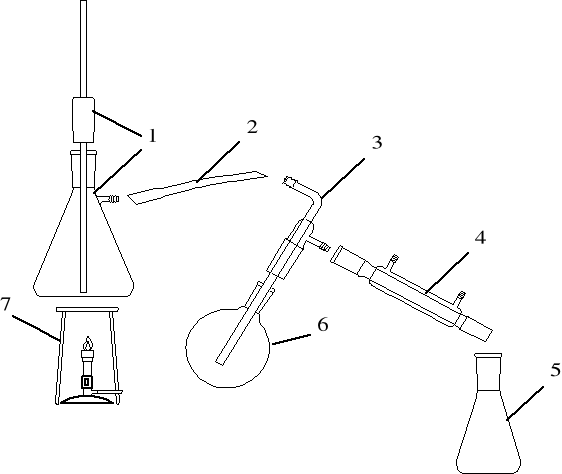
Elementy zestawu do destylacji z parą wodną.
wytwornica pary (kociołek) wraz z rurką odpowietrzającą bezpieczeństwa
wężyk gumowy, 3- rurka doprowadzająca parę, 4- chłodnica,
5-odbieralnik, 6- kolba okrągłodenna z mieszaniną rozdzielaną, 7- ogrzewanie
Destylacja z parą wodną jest stosowana do rozdziału (lub oczyszczania) cieczy wysokowrzących słabo rozpuszczalnych w wodzie, jak np. nitrobenzen. Proces ten prowadzi się tak, aby do naczynia z trudno lotną substancją organiczną dostarczyć ze źródła zewnętrznego strumień pary wodnej. Para ta, wraz z substancją organiczną wydostaje się z naczynia, skrapla się, po czym w odbieralniku substancja oddziela się od warstwy wodnej.
W ten sposób uzyskuje się nie tylko rozdział substancji, ale temperatura tego procesu jest znacznie niższa, niż gdyby stosować zwykłą destylację
(np. dla nitrobenzenu obniżenie temperatury wynosi 100°C!), co często zapobiega rozkładowi związku.
RÓWNOWAGA CIECZ - CIECZ W UKŁADACH DWUSKŁADNIKOWYCH
Mieszanina dwu cieczy o ograniczonej mieszalności stanowi układ dwufazowy (dwie fazy ciekłe). Obszar stężeń, w którym następuje mieszanie się cieczy jest różny dla różnych substancji i zależy od temperatury. Współistniejące ze sobą fazy ciekłe są nasyconymi roztworami jednej cieczy w drugiej , nazywane są mieszaninami skoniugowanymi.
Temperatura decyduje o ciśnieniu cząstkowym obu składników w stanie pary oraz o składzie obu faz ciekłych.
W stałej temperaturze skład mieszanin skoniugowanych jest stały i nie zależy od stosunku ilościowego obu składników. Zmiana tego stosunku zmienia jedynie ilość obu faz.
KLASYFIKACJA MIESZANIN SKONIUGOWANYCH:
♦A mieszalność obu składników rośnie ze wzrostem temperatury, stan pełnej mieszalności osiąga się w temperaturze zwanej górną krytyczną temperaturą mieszania (np. woda- fenol) - powyżej tej temperatury - układ jednofazowy, wewnątrz wykresu - dwie fazy;
♦B mieszalnośc cieczy maleje ze wzrostem temperatury (np.woda -dietyloamina) - dolna temperatura krytyczna, poniżej tej temperatury jest jedna faza - powyżej zaś układ dwufazowy;
♦C mieszalność cieczy rośnie, a następnie maleje (np. woda-nikotyna) dwie temperatury krytyczne - wewnątrz obszaru układ dwufozowy;
W niektórych układach (np. woda-eter dietylowy, woda-chloroform) nie ma obszarów o całkowitej mieszalności.
A B C
Prawo podziału Nernsta:
współczynnik podziału
Prawo podziału Nernsta wykorzystuje się w procesie ekstrakcji, polegającym na takim doborze układu dwu cieczy niemieszających się, aby dzięki dużej różnicy rozpuszczalności oczyszczanej substancji w tych cieczach uzyskać efekt przeprowadzenia jej do jednej z cieczy, pozostawiając towarzyszące zanieczyszczenia w cieczy drugiej.
Stała wartość współczynnika podziału zachowana jest
tylko wtedy, gdy oczyszczana substancja w obu cieczach występuje w tej samej postaci. Gdy w jednej z użytych do ekstrakcji cieczy substancja ulega np. dysocjacji lub asocjacji - obserwuje się odstępstwa od prawa podziału Nernsta.
RÓWNOWAGA CIECZ - CIAŁO STAŁE W UKŁADACH DWUSKŁADNIKOWYCH
Dla tych układów można podać dwa podstawowe typy wykresów fazowych zależnie od tego, czy wydzielająca się podczas oziębiania układu faza stała jest roztworem jednego składnika w drugim (tzw. kryształy mieszane), czy też ze względu na ograniczoną rozpuszczalność obu składników w fazie stałej powstają dwie fazy stałe.
p = const
T Krzywa górna - zależność temperatury
topnienia od składu cieczy - krzywa topnienia;
roztwór ciekły Krzywa dolna - zależność temperatury topnienia
TB od składu fazy stałej - krzywa krzepnięcia;
Obszar środkowy = współistnienie cieczy
i ciała stałego w równowadze
TA roztwór stały Całkowita mieszalność składników w obu fazach
A B (np. stopione Ni+Cu)
Składniki nie mieszają się w stanie stałym (np. lód - NaCl)
p= const
T
roztwór ciekły b
a roztwór roztwory
ciekły Bt
przechłodzone
roztwór
ciekły At
TE
E
składniki stałe A i B E - punkt eutektyczny
A B
xB →
TE - temperatura topnienia mieszaniny o składzie eutektycznym
Krzywa a-E - charakteryzuje równowagę roztworu ciekłego z fazą stałą A
Krzywa b-E - charakteryzuje równowagę roztworu ciekłego z fazą stałą B.
Pod tymi krzywymi - obszary przechłodzenia i przesycenia- czyli braku równowagi ciekłego roztworu.
Poniżej TE układ składa się tylko z dwóch faz stałych, które stanowią mieszaninę kryształów czystych składników A i B.
W punkcie eutektycznym trójfazowy układ:
roztwór - substancja A - substancja B
ma liczbę stopni swobody równą zero. Czyli, że zmiana jednego z parametrów stanu układu spowoduje zmianę stanu równowagi, przy czym zniknie jedna z faz.
Jeżeli zmieszamy lód w 0°C i stały NaCl, to dla każdej ilości dodanej soli mieszanina w stanie ciekłego roztworu będzie miała temperaturę krzepnięcia niższą od 0°C. Taką mieszaninę nazywa się mieszaniną oziębiającą.
Najniższą temperaturę, jaka można osiągnąć w tej mieszaninie jest temperatura punktu eutektycznego, wynosząca ok. - 20°C. Poniżej tej temperatury pod ciśnieniem atmosferycznym istnieją tylko stałe NaCl i lód.
Temperatura eutektyczna dla mieszanin niektórych innych soli z lodem może być niższa, np. dla CaCl2 wynosi ok. - 50°C.
Mieszaniny oziębiające mają zastosowanie praktyczne.
RÓWNOWAGA W UKŁADACH TRÓJSKŁADNIKOWYCH
Wykresy fazowe charakteryzujące równowagę w takich układach obrazuje się za pomocą tzw. trójkąta Gibbsa.
Wierzchołki tego trójkąta - odpowiadają czystym składnikom A,B,C;
Boki == stężenia roztworów dwuskładnikowych;
Punkty wewnątrz trójkąta == stężenie układu trójskładnikowego;
Wielkość obniżenia lub podwyższenia temperatury wrzenia czy krzepnięcia roztworu w stosunku do tych temperatur dla czystego rozpuszczalnika zależy od stężenia roztworu.
pi = pio xi
Prężność pary danego składnika nad roztworem jest proporcjonalna do ułamka molowego tego składnika w roztworze. Przy czym pio jest prężnością pary nad czystym składnikiem i.
p = p1o + x2 (p2o - p1o)
p = p1 + p2
Twrz B o wyższej prężności pary < Twrz A o niższej prężności pary
p1o - p Δp
---------- = x2 = -------
p1o p1o
Względne obniżenie prężności pary rozpuszczalnika nad roztworem jest równe ułamkowi molowemu substancji rozpuszczonej w roztworze
pA = pAo ⋅ xA
pAo - pA
------------- = xB
pAo
Względne obniżenie ciśnienia pary nasyconej rozpuszczalnika nad roztworem substancji nielotnej jest wprost proporcjonalne do ułamka molowego składnika nielotnego w roztworze
Δ Twrz = Keb ⋅ m`
zmiana temperatury wrzenia roztworu
stała ebulioskopowa
Keb ⋅ m
Δ Twrz = -----------
M ⋅ mrozp
Δ Twrz = Keb
Δ Tkr = Kkr ⋅ m`
Kkr ⋅ m
Δ Tkr = -----------
M ⋅ mrozp
Δ Tkr = Kkr
xA (ciecz) ⋅ pAo
xA (para) = ---------------------
pA + pB
xB (ciecz) ⋅ pBo
xB (para) = ---------------------
pA + pB
xA (para) xA (ciecz) ⋅ pAo
--------------- == -------------------------
xB (para) xB (ciecz) ⋅ pBo
para, w porównaniu z cieczą z której powstała jest zawsze bogatsza w składnik bardziej lotny
Odczytując wykresy należy pamiętać: w danej temperaturze od składu cieczy zależy prężność jej pary nasyconej, a z wartości tej prężności można wnioskować o składzie pary nad cieczą
W punkcie ekstremalnym skład cieczy jest taki sam jak skład pary nad tą cieczą , a temperatura wrzenia takiego roztworu wykazuje minimum (dla maksimum prężności pary) lub maksimum (dla minimum prężności pary). Azeotropów nie można rozdzielić na czyste składniki metodą destylacji i trzeba stosować inne metody!!
Jeżeli mamy układ dwu cieczy niemieszających się, to każda z nich ma takie właściwości, jak gdyby znajdowała się sama w układzie.
Temperatura wrzenia takiego układu jest stała przy danym ciśnieniu zewnętrznym, nie zależy od stosunku ilościowego składników i jest zawsze niższa od temperatury wrzenia każdego z czystych składników występujących osobno.
Jeżeli do układu złożonego z dwóch niemieszających się cieczy A i B wprowadzi się trzecią substancję rozpuszczającą się w obu cieczach, to substancja ta tworzy roztwór bardziej stężony z tą cieczą, w której wykazuje większą rozpuszczalność.
Stosunek stężeń tej substancji w obydwu warstwach ciekłych w stałej temperaturze ma wartość stałą:
Csubst. w cieczy A
-------------------- == K dla T = const
Csubst. w cieczy B
Lepszą wydajność procesu ekstrakcji osiągnie się przez wielokrotnie powtórzonym wytrząsaniu roztworu z małymi porcjami rozpuszczalnika, w porównaniu z użyciem dużej jego objętości jeden raz.
Temperatura topnienia mieszaniny o składzie eutektycznym TE jest najniższą temperaturą topnienia mieszaniny obu składników.