WĘGLOWODORY - związki organiczne zawierające atomy węgla i wodoru.
WĘGLOWODORY
Nasycone Nienasycone Aromatyczne
(Alkany) (Areny)
Alkeny Alkiny
Węglowodory nasycone (alkany) - węglowodory zawierające wyłącznie pojedyncze wiązania: C - C i C - H; np. metan, etan,.
Węglowodory nienasycone (alkeny, alkiny) - węglowodory zawierające podwójne (alkeny) i potrójne (alkiny) wiązania między atomami węgla: C = C, C ≡ C; np. eten (etylen), propen (propylen), etyn (acetylen);
Węglowodory aromatyczne (areny) - węglowodory pierścieniowe w których istnieje układ naprzemiennie położonych wiązań podwójnych i pojedynczych między atomami węgla; np. benzen, toluen, fenol, anilina, naftalen.
ALKANY
Węglowodory nasycone o budowie łańcuchowej, wzorze ogólnym: CnH2n+2 (n - dowolna liczba całkowita) i końcówce w nazwie -an.
Alkany tworzą szereg homologiczny czyli szereg związków o podobnej budowie, którego poszczególne człony, tzw. homologi, różnią się o grupę -CH2.
Nazwy alkanów tworzy się zgodnie z liczbą atomów węgla w łańcuchu, z wyjątkiem pierwszych czterech, których nazwy mają korzenie historyczne. Od piątego bazują na liczebnikach greckich. Przyrostek -an wskazuje, że związek zalicza się do alkanów.
Usunięcie atomu wodoru z alkanu daje grupę alkilową R.
Nazwy grup alkilowych powstają w wyniku zastąpienia końcówki -an przyrostkiem - yl
SZEREG HOMOLOGICZNY ALKANÓW
Liczba atomów węgla |
Wzór sumaryczny CnH2n+2 |
Nazwa |
Grupa alkilowa -CnH2n+1 |
Nazwa grupy alkilowej |
1 |
CH4 |
Metan |
-CH3 |
metyl (gr metylowa) |
2 |
C2H6 |
Etan |
-C2H5 |
etyl |
3 |
C3H8 |
Propan |
-C3H7 |
propyl |
4 |
C4H10 |
Butan |
-C4H9 |
butyl |
5 |
C5H12 |
Pentan |
-C5H11 |
pentyl |
6 |
C6H14 |
Heksan |
-C6H13 |
heksyl |
7 |
C7H16 |
Heptan |
-C7H15 |
heptyl |
8 |
C8H18 |
Oktan |
-C8H17 |
oktyl |
9 |
C9H20 |
Nonan |
-C9H19 |
nonyl |
10 |
C10H22 |
Dekan |
-C10H21 |
dekyl |
Grupę propylową często przedstawia się w postaci izopropylowej (zjawisko izomerii w alkanach).
propyl (grupa propylowa): -C3H7 ![]()
izopropyl (grupa izopropylowa): -C3H7 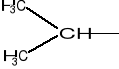
Nazewnictwo alkanów
Obowiązujący system nazewnictwa związków chemicznych jest ustalany przez Międzynarodową Unię Chemii Czystej i Stosowanej - IUPAC (ang. International Union of Pure and Chemistry).
Nazwa chemiczna ma wg IUPAC trzy części: przedrostek, rdzeń i przyrostek.
Rdzeń - określa główną część cząsteczki i mówi o liczbie atomów węgla, które się w
niej znajdują ( C,C,C, -propan ; C,C,C,C,C, - pentan)
Przyrostek - określa rodzinę związków, do której należy dana cząsteczka
(-an alkan, -en alken, -yn alkin)
Przedrostek - określa położenie podstawników w rdzeniu
PRZEDROSTEK - RDZEŃ - PRZYROSTEK
Wskazówki do tworzenia nazw alkanów:
Wyszukać najdłuższy łańcuch węglowy w cząsteczce związku.
Ponumerować wszystkie atomy węgla w najdłuższym łańcuchu węglowym rozpoczynając od najbliższego punktu rozgałęzienia (od podstawnika).
Określić i ponumerować podstawniki
Jeśli obecne są dwa różne podstawniki (lub więcej) zapisujemy je w kolejności alfabetycznej.
Jeśli natomiast obecne są dwa (lub więcej) takie same podstawniki używamy przedrostka di-, tri-, tetra- itd.
Zapisać nazwę w postaci jednego słowa, stosując łączniki do rozdzielenia różnych przedrostków i stosując przecinki do rozdzielenia cyfr.
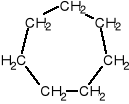
CYKLOALKANY
Cykloalkany - węglowodory nasycone o budowie pierścieniowej - alkany zamknięte w pierścień.
Wzór ogólny: CnH2n lub (CH2)n
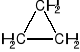
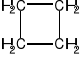
Cykloalkany zawierają pierścienie o jednostkach -CH2 i przedstawiane są w postaci wieloboku:
cyklopropan ![]()
cyklobutan ![]()
cyklopentan 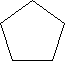
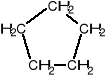
cykloheksan 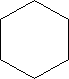
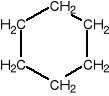
cykloheptan 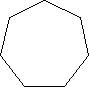
Zasady nazewnictwa cykloalkanów:
Zasady nazewnictwa cykloalkanów są podobne do zasad ustalonych dla alkanów.
Obowiązują tu jedynie trzy nowe zasady:
Numerowanie atomów węgla w cykloalkanach rozpoczyna się od punktu dołączenia podstawnika.
Ustalenie liczby atomów węgla w pierścieniu i w największym podstawniku - jeśli liczba atomów węgla w pierścieniu jest większa lub równa liczbie atomów węgla w największym podstawniku, to związek przyjmuje nazwę cykloalkanu podstawionego grupą alikową. W przeciwnym wypadku - nazwę alkanu podstawionego grupą cykloalkilową.
3. W przypadku dwóch podstawników (lub więcej) atomy węgla numerujemy tak, aby suma lokautów była jak najmniejsza.
ALKENY
Węglowodory nienasycone o budowie łańcuchowej, wzorze ogólnym: CnH2n
(n - dowolna liczba całkowita) i końcówce w nazwie -en. Alkeny posiadają minimum jedno wiązanie podwójne pomiędzy atomami węgla.
Najprostszymi przedstawicielami alkenów są:
etylen (eten) ![]()
gr alkilowa: CH2 = CH- etenyl (winyl)
propylen (propen) ![]()
CH2 = CH-CH2- propenyl
Nazewnictwo alkenów i cykloalkenów
Nazwę alkenu wyprowadzamy z nazwy odpowiedniego alkanu, zamieniając końcówkę -an na -en. Zasady nazewnictwa są następujące:
Wyszukać najdłuższy łańcuch zawierający podwójne wiązanie.
Ponumerować atomy węgla w łańcuchu, zaczynając od tego końca, bliżej którego znajduje się wiązanie podwójne. (a)
Gdy wiązanie podwójne jest równoodległe od obu końców, należy rozpocząć numerowanie od końca bliższego pierwszego rozgałęzienia. (b)
Napisać pełną nazwę, numerując podstawniki zgodnie z ich pozycją w łańcuchu
i wyliczając je w porządku alfabetycznym
Wskazać pozycję wiązania podwójnego wymieniając numer pierwszego atomu węgla alkenu.
Gdy występuje więcej wiązań podwójnych, wskazuje się pozycję każdego z nich
i używa się przedrostka -dien, - trien itd. (c)
W cykloalkenach rozpoczyna się numerowanie atomów węgla tak, aby wiązanie podwójne było między C1 i C2 (d)
ALKINY
Węglowodory nienasycone o budowie łańcuchowej, wzorze ogólnym CnH2n-2
(n - dowolna liczba całkowita) i końcówce w nazwie - yn. Są związkami nietrwałymi gdyż są nienasycone - posiadają minimum jedno wiązanie potrójne między atomami węgla.
Najprostszym alkinem jest acetylen (etyn): C2H2 ![]()
Nazewnictwo alkinów
Do alkinów stosuje się ogólne zasady nazewnictwa węglowodorów.
W nazewnictwie stosuje się przyrostek -yn lub -in (po g, k, l) używany w celu oznaczenia alkinu.
Numerowanie głównego łańcucha rozpoczyna się od końca bliższego wiązania potrójnego tak, by to wiązanie otrzymało najniższy lokant (numer):
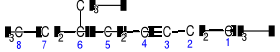
6-metylo-3-oktyn
W związkach zawierających wiązanie podwójne i potrójne (bez podstawnika), numerowanie łańcucha zaczynamy od końca bliższego pierwszego wiązania wielokrotnego:
![]()
1-hepten-5-yn
![]()
5-hepten-1-yn
Jeżeli wiązanie podwójne i potrójne jest równoległa od obu końców, niższy numer należy nadać wiązaniu podwójnemu:
![]()
1-hepten-6-yn
Jeżeli obecny jest podstawnik oraz wiązanie podwójne i potrójne, atomy węgla numerujemy tak, aby podstawnik posiadał najniższy lokant:
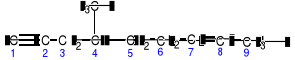
4-metylo-7-nonen-1-yn
WĘGLOWODORY AROMATYCZNE- są to związki o budowie pierścieniowej,
w których między atomami węgla występują wiązania zdelokalizowane.
Wiązanie zdelokalizowane - utworzone jest z 6 elektronów - sekstetu elektronowego (sekstet jest wiązaniem trwałym) i łączy ono wszystkie atomy tworzące pierścień.
Ogólnie można powiedzieć, że węglowodory aromatyczne to układy pierścieniowe sześcioczłonowe, w których znajdują się wiązania podwójne naprzemian z wiązaniami pojedynczymi.
BENZEN jest najprostszym węglowodorem aromatycznym:
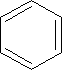
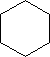
Koło wewnątrz pierścienia oznacza
zdelokalizowany sekstet elektronowy.
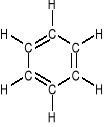
C6H6
Nazewnictwo związków aromatycznych
W przypadku najprostszych pochodnych benzenu typu: C6H6X (jednopodstawionych) nazwę tworzy się dodając nazwę podstawnika „X” w postaci przedrostka do słowa benzen, np.:
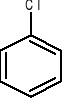
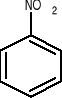
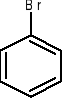
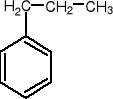
chlorobenzen nitrobenzen bromobenzen propylobenzen
Jednak w przypadku grup: X =
-NH2 (gr. aminowa),
-CH3 (gr. metylowa),
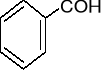
-OH (gr. hydroksylowa),
-COOH (gr. karboksylowa),
-SO3H (gr. sulfonowa)
-CN (gr. nitrylowa)
![]()
(gr. ketonowa)
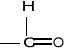
(gr. aldehydowa)
-CH=CH2 (gr. winylowa)
zwykle stosuje się nazwy zwyczajowe, np.:
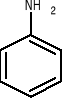
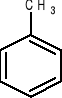
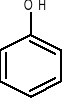
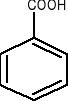
anilina toluen fenol kwas benzoesowy
(aminobenzen) (metylobenzen) (hydroksybenzen)
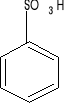
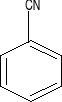
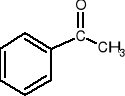
kwas benzosulfonowy benzonitryl acetofenon
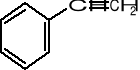
benzaldehyd styren
Jeżeli do pierścienia benzenowego przyłączone są dwie grupy, to należy określić nie tylko ich rodzaj, ale również ich położenie.
Gdy podstawniki zajmują położenie 1 i 2 → przedrostek orto
Gdy podstawniki zajmują położenie 1 i 3 → przedrostek meta
Gdy podstawniki zajmują położenie 1 i 4 → przedrostek para
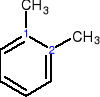
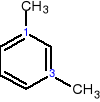
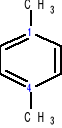
1,2-dimetylobenzen 1,3-dimetylobenzen 1,4-dimetylobenzen
orto-dimetylobenzen meta-dimetylobenzen para-dimetylobenzen
orto-ksylen meta-ksylen para-ksylen
o-ksylen m-ksylen p-ksylen
Jeżeli grupa alkilowa Przyłączona do benzenu zawiera 6 lub mniej atomów węgla, to traktuje się ją jako podstawnik i nazwę tworzy się podobnie jak w przypadku podstawionych pochodnych benzenu, np.:
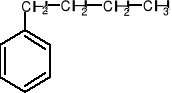
butylobenzen
Jeżeli grupa alkilowa zawiera więcej niż 6 atomów węgla, to benzen traktuje się jako podstawnik i jest to wówczas alkan podstawiony grupą aromatyczną (fenylową), np.:
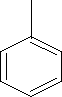
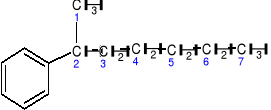
grupa fenylowa 2-fenyloheptan
Gdy benzen jest podstawiony więcej niż dwoma podstawnikami, wówczas stosuje się numerowanie węgli w pierścieniu benzenowym tak, aby suma lokantów była jak najmniejsza, a podstawniki wymienia się w kolejności alfabetycznej, np.:
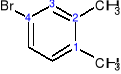
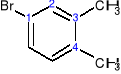
4-bromo-1,2-dimetylobenzen a nie: 1-bromo-3,4-dimetylobenzen
∑=7 ∑=8
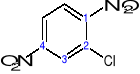
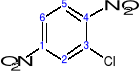
2-chloro-1,4-dinitrobenzen a nie: 3-chloro-1,4-dinitrobenzen
∑=7 ∑=8
AROMATYCZNE ZWIĄZKI POLICYKLICZNE
Oprócz jednopierścieniowych węglowodorów aromatycznych istnieją także wielopierścieniowe, policykliczne węglowodory aromatyczne o skondensowanych pierścieniach benzenowych, np.:
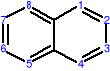
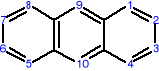
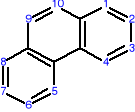
naftalen antracen fenantren
Wpływ podstawnika znajdującego się w pierścieniu aromatycznym na położenie nowego podstawnika:
Podstawniki związane z pierścieniem aromatycznym wywierają wpływ na aktywność związku, a także wskazują, w jakim położeniu znajdzie się następna podstawiona grupa.
Podstawniki możemy podzielić na dwa rodzaje, przyjmując jako kryterium podziału pozycję w jaką dany podstawnik kieruje nowo podstawioną grupę:
Podstawniki |
Położenie w jakie jest kierowany nowy podstawnik |
Wpływ podstawnika na reaktywność związku |
Przykłady podstawników |
I rodzaju |
orto i para |
Zwiększają reaktywność związku aromatycznego |
-NH2 (aminowa) -OH (hydroksylowa) -R (alkilowa) -Ar (arylowa) |
|
|
Zmniejszają reaktywność związku aromatycznego |
Halogenki (fluorowce): -F, -Cl, -Br, -I |
II rodzaju |
meta |
Zmniejszają reaktywność związku aromatycznego |
-NO2 (nitrowa) -COOH (karboksylowa) -SO3H (sulfonowa) -COH (aldehydowa) -CN (nitrylowa) -COR (acylowa) |
ALKOHOLE
Pochodne węglowodorów, zawierające w cząsteczkach grupę hydroksylową -OH (wodorotlenową), która jest grupą funkcyjną.
Ogólny wzór alkoholi: R - OH R grupa alkilowa
-OH grupa hydroksylowa
Podział alkoholi:
1. Ze względu na liczbę grup hydroksylowych:
a) monohydroksylowe (jednowodorotlenowe)
np. CH3-OH metanol
b) polihydroksylowe (wielowodorotlenowe)
np. HO-CH2CH2-OH 1,2-etanodiol (glikol etylenowy)
2. Ze względu na rzędowość atomu węgla, przy którym znajduje się grupa -OH:
a) I-rzędowe
np. ![]()
1-propanol 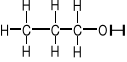
b) II-rzędowe
np. ![]()
2-propanol 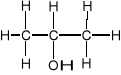
III-rzędowe
np. 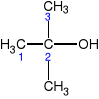
2-metylo-2-propanol 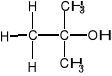
3. Ze względu na rodzaj grupy węglowodorowej:
a) alifatyczne
np. ![]()
etanol
b) cykliczne
np. 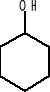
cykloheksanol
aromatyczne
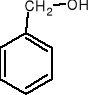
fenylometanol
np.
Nazewnictwo alkoholi
Nazwy prostych alkoholi zgodnie z nazewnictwem IUPAC tworzy się od alkanu macierzystego z dołączoną końcówką -ol.
Zasady nazewnictwa są następujące:
wybór najdłuższego łańcucha węglowego, zawierającego grupę hydroksylową
i utworzenie nazwy macierzystej z dołączoną końcówką -ol,ponumerowanie łańcucha alkanowego, rozpoczynając od końca bliższego grupy hydroksylowej,
ponumerowanie podstawników zgodnie z ich położeniem w łańcuchu i zapisanie nazwy, wypisując podstawniki w kolejności alfabetycznej.
FENOLE
Pochodne węglowodorów aromatycznych, w których grupa hydroksylowa -OH jest bezpośrednio związana z pierścieniem aromatycznym.
Ogólny wzór fenoli: Ar-OH Ar grupa arylowa (aromatyczna)
-OH grupa hydroksylowa
Nazwy systematyczne fenoli tworzy się dodając przedrostek hydroksy do nazwy węglowodoru. Częściej jednak używane są nazwy zwyczajowe.
Przykłady
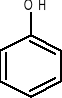
fenol
(hydroksybenzen)
(benzol)
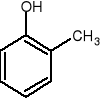
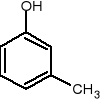
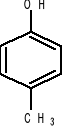
1,2-metylofenol 1,3-metylofenol 1,4-metylofenol
o-krezol m-krezol p-krezol
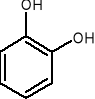
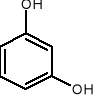
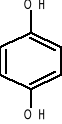
1,2-benzenodiol 1,3-benzenodiol 1,4-benzenodiol
pirokatechina rezorcyna hydrochinon
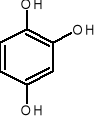
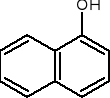
1,2,4-benzenotriol 1-naftol
ETERY
Eterami nazywamy związki, które wywodzą się z cząsteczki wody, w których zastąpiono oba atomy wodoru grupami organicznymi (grupa alkilową, arylową lub winylową).
![]()
![]()
Atom tlenu może znajdować się w łańcuchu otwartym lub w pierścieniu.
Nazwy prostych eterów tworzy się w ten sposób, że po słowie eter wymienia się nazwy grup połączonych z atomem tlenu, np.
CH2CH3 - O - CH3 eter etylowo-metylowy
CH3 - O - CH3 eter dimetylowy
W bardziej złożonych przypadkach, gdy w cząsteczce znajdują się inne grupy funkcyjne, część eterowa uznawana jest za podstawnik, a nazwę związku tworzy się przez dodanie nazwy grupy przyłączonej do atomu tlenu z końcówką -oksy, np.:
![]()
1-chloro-2-metoksyetan
Odmianą eterów są tzw. EPOKSYDY - trójczłonowe związki pierścieniowe:
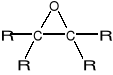
Najważniejszym epoksydem jest tlenek etylenu (1,2-epoksyetan) (oksiran) :
![]()
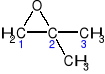
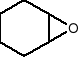
Inne przykłady epoksydów:
2-metylo-1,2-epoksypropan 1,2-epoksycyklohekasn
ZWIĄZKI KARBONYLOWE
związki organiczne, w których występuje grupa funkcyjna o nazwie karbonylowa:
![]()
Do związków tych zaliczamy m.in.:
Aldehydy - związki organiczne, w których grupa karbonylowa połączona jest z grupą
alkilową R (bądź arylową Ar) oraz z atomem wodoru:
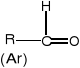
Nazwę aldehydu tworzy się od nazwy odpowiedniego alkanu dodając końcówkę -al
Najdłuższy łańcuch, w którym występuje grupa aldehydowa, jest łańcuchem głównym.
Atom węgla tej grupy otrzymuje nr 1.
Nazwy zwyczajowe aldehydów pochodzą od nazwy kwasów, do których się one utleniają,
w których słowo kwas zastąpiono słowem aldehyd.
Przykłady:
![]()
metanal (aldehyd mrówkowy) formaldehyd
![]()
etanal (aldehyd octowy) acetaldehyd
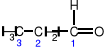
propanal (aldehyd propionowy)
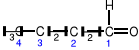
butanal (aldehyd masłowy)
Ketony - związki organiczne, w których grupa karbonylowa połączona jest z dwoma grupa alkilowymi bądź aromatycznymi, bądź z jedną alkilową a drugą aromatyczną:
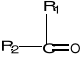
lub 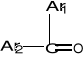
lub 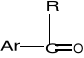
Nazwę ketonu tworzy się od nazwy odpowiedniego alkanu dodając końcówkę -on
Najdłuższy łańcuch, w którym występuje grupa ketonowa, jest łańcuchem głównym.
Numerowanie atomów węgla rozpoczyna się od końca najbliższego karbonylowego atomu węgla.
Przykłady:
![]()
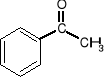
2-butanon aceton (propanon) acetofenon
Kwasy karboksylowe - związki organiczne, w których grupa karbonylowa połączona jest z grupą hydroksylową -OH oraz z grupą alkilową R, bądź aromatyczą Ar:
(zawierają w swej cząsteczce grupę karboksylową -COOH )
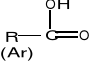
System nazewnictwa kwasów karboksylowych jest dwojaki.
Gdy grupa karboksylowa jest przyłączona do:
łańcucha → kwas…..owy
pierścienia→ kwas…..karboksylowy
Atom węgla grupy karboksylowej w obu przypadkach otrzymuje nr 1.
Nazwy kwasów dwukarboksylowych tworzy się przez dodanie końcówki:
-odiowy
-odikarboksylowy
Przykłady:
![]()
![]()
kwas metanowy (kwas mrówkowy) kwas etanowy (kwas octowy)
![]()
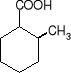
kwas butanowy (kwas masłowy) kwas 2-metylocykloheksanokarboksylowy
Estry - związki o ogólnym wzorze R1COOR2 (Ar1COOAr2)
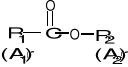
Nazwy estrów tworzy się określając, z jakiego kwasu karboksylowego one powstały oraz jakie grupy alkilowe wprowadzono w miejsce atomu wodoru w kwasie.
Nazwa estru ma końcówkę -an.
Przykłady:
![]()
![]()
octan metylu octan propylu
ester metylowy kwasu octowego ester propylowy kwasu octowego
[od kwasu octowego (etanowego)]
15
Ile atomów węgla
Jaka to rodzina związków
Określenie miejsca podstawnika
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
więcej podobnych podstron