Obliczenia:
Obliczenia wartości k (stałej szybkości reakcji chemicznej) wykonałem przy pomocy metody najmniejszych kwadratów.
Nr. |
x |
y |
X2 |
x*y |
Y2 |
x+y |
(x+y)2 |
|
1 |
1 |
0,017 |
1 |
0,017 |
0,000 |
1,017 |
1,033 |
0,00026 |
2 |
2 |
0,044 |
4 |
0,087 |
0,002 |
2,044 |
4,176 |
0,00008 |
3 |
3 |
0,074 |
9 |
0,223 |
0,006 |
3,074 |
9,452 |
0,00089 |
4 |
4 |
0,118 |
16 |
0,473 |
0,014 |
4,118 |
16,959 |
0,00145 |
5 |
5 |
0,185 |
25 |
0,923 |
0,034 |
5,185 |
26,881 |
0,00055 |
6 |
6 |
0,221 |
36 |
1,329 |
0,049 |
6,221 |
38,706 |
0,00149 |
7 |
7 |
0,288 |
49 |
2,014 |
0,083 |
7,288 |
53,110 |
0,00059 |
8 |
8 |
0,341 |
64 |
2,726 |
0,116 |
8,341 |
69,568 |
0,00053 |
9 |
9 |
0,404 |
81 |
3,636 |
0,163 |
9,404 |
88,435 |
0,00014 |
10 |
10 |
0,465 |
100 |
4,654 |
0,217 |
10,465 |
109,524 |
0,00001 |
11 |
11 |
0,527 |
121 |
5,802 |
0,278 |
11,527 |
132,882 |
0,00006 |
12 |
13 |
0,644 |
169 |
8,372 |
0,415 |
13,644 |
186,158 |
0,00042 |
13 |
15 |
0,765 |
225 |
11,482 |
0,586 |
15,765 |
248,550 |
0,00146 |
14 |
17 |
0,887 |
289 |
15,082 |
0,787 |
17,887 |
319,951 |
0,00315 |
15 |
19 |
0,986 |
361 |
18,734 |
0,972 |
19,986 |
399,441 |
0,00261 |
16 |
21 |
1,090 |
441 |
22,889 |
1,188 |
22,090 |
487,965 |
0,00262 |
17 |
23 |
1,184 |
529 |
27,221 |
1,401 |
24,184 |
584,842 |
0,00168 |
18 |
28 |
1,430 |
784 |
40,036 |
2,045 |
29,430 |
866,117 |
0,00077 |
19 |
33 |
1,661 |
1089 |
54,818 |
2,759 |
34,661 |
1201,395 |
0,00000 |
20 |
38 |
1,889 |
1444 |
71,797 |
3,570 |
39,889 |
1591,164 |
0,00101 |
21 |
43 |
2,103 |
1849 |
90,428 |
4,422 |
45,103 |
2034,278 |
0,00606 |
|
316 |
15,324 |
7686 |
382,741 |
19,106 |
331,324 |
8470,588 |
0,02583 |
Równanie Prostej na wykresie ma wzór:
![]()
Gdzie: A0 - Absorbancja w czasie 0
k - Stała szybkości
T - czas [min]
Obliczenie wspólczynika kierunkowego k obliczanm ze wzoru:
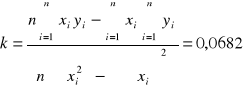
odchylenie standardowe od tej wartości to:
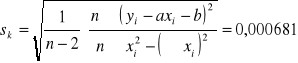
Wiec stała szybkości reakcji dla Próbki w której znajdowało się 15 ml KMnO4 to k=0,0682±0,0007[min-1]
Dla próbki zawierającej 10 KMnO4:
nr |
x |
y |
X2 |
xy |
Y2 |
x+y |
(x+y)2 |
|
1 |
1 |
0,020 |
1 |
0,020 |
0,000 |
1,020 |
1,041 |
0,02377 |
2 |
2 |
0,034 |
4 |
0,068 |
0,001 |
2,034 |
4,137 |
0,01250 |
3 |
3 |
0,048 |
9 |
0,143 |
0,002 |
3,048 |
9,289 |
0,00485 |
4 |
4 |
0,067 |
16 |
0,270 |
0,005 |
4,067 |
16,544 |
0,00111 |
5 |
6 |
0,114 |
36 |
0,685 |
0,013 |
6,114 |
37,383 |
0,00103 |
6 |
8 |
0,176 |
64 |
1,405 |
0,031 |
8,176 |
66,842 |
0,00683 |
7 |
10 |
0,260 |
100 |
2,601 |
0,068 |
10,260 |
105,270 |
0,01217 |
8 |
12 |
0,373 |
144 |
4,480 |
0,139 |
12,373 |
153,100 |
0,01192 |
9 |
14 |
0,499 |
196 |
6,985 |
0,249 |
14,499 |
210,218 |
0,00916 |
10 |
16 |
0,618 |
256 |
9,880 |
0,381 |
16,618 |
276,142 |
0,00795 |
11 |
21 |
0,962 |
441 |
20,200 |
0,925 |
21,962 |
482,326 |
0,00063 |
12 |
26 |
1,279 |
676 |
33,256 |
1,636 |
27,279 |
744,148 |
0,00014 |
13 |
31 |
1,617 |
961 |
50,141 |
2,616 |
32,617 |
1063,899 |
0,00491 |
14 |
36 |
1,921 |
1296 |
69,153 |
3,690 |
37,921 |
1437,997 |
0,00870 |
|
190 |
7,988 |
4200 |
199,288 |
9,757 |
197,988 |
4608,334 |
0,10566 |
Wartości dla tego roztworu obliczyłem w taki sam sposób ja dla poprzedniego roztworu. Stała k = 0,0802 ± 0,0023[min-1]
Wnioski:
W wykonanym ćwiczeniu dokonałem pomiaru stałej szybkości rozpadu kompleksu trójszczawianomanganowego. Obliczeń dokonałem za pomocą pomiaru absorbancji światła o długości 400 nm. Zbadałem 2 próbki w których znajdowało się 15 i 10 ml KMnO4. Uzyskałem następujące wyniki odpowiednio: k = 0,0682 ± 0,0007[min-1]
i k = 0,0802 ± 0,0023[min-1]
Wyszukiwarka
Podobne podstrony:
Obliczenia24, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
więcej podobnych podstron