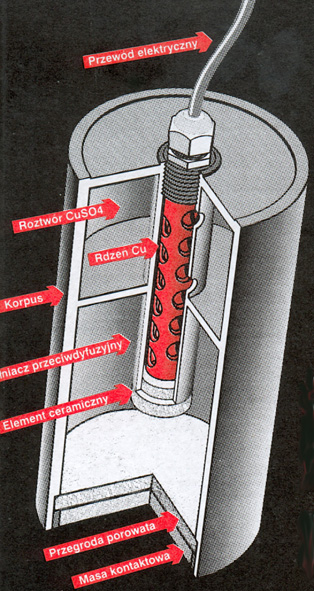
Korpus z tworzywa sztucznego, podzielony wewnątrz na dwie komory, połączone ze sobą obudową elektrody wewnętrznej, od której wyprowadzony jest na zewnątrz przewód elektryczny,
Rdzeń miedziany o odpowiednio rozwiniętej powierzchni,
Pojemnik główny na nasycony roztwór siarczanu miedzi,
Obudowa elektrody wewnętrznej z porowatym elementem ceramicznym, na życzenie także membrana jonowymienna,
Pojemnik na wypełniacz przeciwdyfuzyjny oraz wypełnienie chłonące z zewnątrz wodę, zamknięty ceramiczną przegrodą porowatą,
Masa kontaktowa zamykająca elektrodę, która umożliwia natychmiastowe montowanie elektrody w ziemi bez potrzeby wielogodzinnego moczenia w wodzie,
Dostarczany razem z elektrodą gumowy kołpak, zamykający szczelnie korpus i utrzymujący warstwę masy kontaktowej. Jego zadaniem jest zachowanie w elektrodzie wilgoci w czasie magazynowania i transportu elektrody.
Kołpak powinien być usunięty przed zamontowaniem elektrody w ziemi.
2. Rodzaje elektrod
Istnieją trzy rodzaje elektrod. Pierwsze dwa rodzaje to anoda i katoda. Anoda to ta z elektrod, która przyjmuje ładunek ujemny lub wysyła dodatni, zaś katoda to elektroda wysyłająca ładunek ujemny lub przyjmująca dodatni. Ładunek elektryczny przepływający między anodą i katodą może przybierać formę wolnych elektronów lub jonów. Trzecim rodzajem są elektrody oddziałujące na przestrzeń swoim potencjałem - przykładem są tu siatki w lampie elektronowej, zwłaszcza siatka pierwsza. Czasami elektrody te przyjmują lub wysyłają nośniki prądu, jak np. siatka druga w tetrodzie, jednak są nadal nazywane siatkami, gdyż ich głównym celem jest oddziaływanie na rozkład pola elektrycznego. Niekiedy tego rodzaju elektrody noszą też inne nazwy, np. w lampie oscyloskopowej nazywane są płytkami odchylającymi.
Inaczej potencjał elektrody, siła elektromotoryczna ogniwa zbudowana z danej elektrody i elektrody porównawczej; potencjał elektrody normalny (standardowy, E0), siła elektromotoryczna (zmierzona w temp. 25°C) ogniwa zbudowane z elektrody, w której składniki określające potencjał występują w stanie podstawowym (np. aktywność jonów elektrolitu jest równa 1) i elektrody wodorowej normalnej, której potencjał przyjęto za równy zeru.
4. Ogniwo galwaniczne
Ogniwo, w którym źródłem prądu są reakcje chemiczne zachodzące między elektrodą, a elektrolitem. Dwie elektrody zanurzone w elektrolicie (półogniwa) tworzą ogniwo galwaniczne. Różnica potencjałów elektrod gdy przez ogniwo nie płynie prąd jest równa sile elektromotorycznej ogniwa (SEM).Przykłady ogniw galwanicznych:
Ogniwa stosowane w potencjometrii dają SEM do 1500mV. Mają jednak bardzo mała pojemność dlatego stosuje się do pomiaru SEM przyrządy kompensacyjne lub pehametry elektroniczne. Metoda kompensacyjna znajduje zastosowanie w przypadku dokładnego oznaczania ph lub szczególnie dokładnego wyznaczania krzywych miareczkowania. Wyróżniamy dwa rodzaje potencjometrów:
6. Zasada potencjometrycznego oznaczania stężenia
Oparta jest na zależności potencjału elekt. od aktywności jonów , względem których jest ona odwracalna. Nieznaną aktywność można obliczyć bezpośrednio ze wzoru Nernsta na potencjał elekt., jeśli oznaczamy wartość tego potencjału oraz znamy potencjał standardowy:
a) utworzyć ogniwo z elektrody wskaźnikowej i elektrody porównawczej
b) obydwie elektrody łączymy z potencjometrem i mierzymy siłę SEM
c) znając E oraz pot. elektrody porównawczej obliczamy pot. elektrody wskaźnikowej i następnie aktywność oznaczonych jonów - ze wzoru Nernsta.
Do ilościowego oznaczenia innych jonów np. słabych kwasów i zasad stosuje się miareczkowanie potencjometryczne.
7. Miareczkowanie potencjometryczne
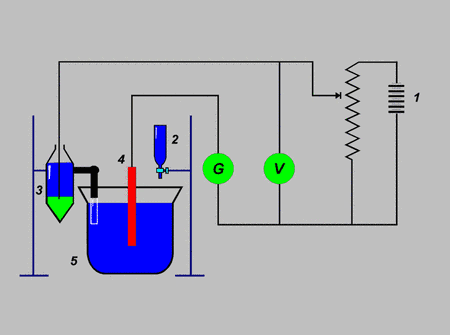
Punkt równoważnikowy wyznacza się na podstawie zmian SEM odpowiedniego ogniwa. Jak zawsze ogniwo takie musi się składać z elektrody wskaźnikowej - której potencjał jest zależny od stężenia substancji miareczkowanej, natomiast drugiej porównawczej jest stały. Obie elektrody powinny być połączone kluczem elektrolitycznym albo być zanurzone w roztworze miareczkowym.
Miareczkowanie potencjometryczne stosuje się gdy niemożliwe jest użycie wskaźników barwnych lub kiedy trzeba bezpośrednio za pomocą pojedynczego miareczkowania oznaczyć dwie lub więcej substancji.
Oznaczenia: 1 - akumulator, 2 - biureta, 3 - elektroda porównawcza, 4 - elektroda wskaźnikowa, 5 - naczynie z badanym roztworem
Oznaczanie potencjometryczne polega na zanurzeniu w badanym roztworze dwóch elektrod (porównawczej i wskaźnikowej), których potencjał zależy jedynie od aktywności badanych jonów. Miareczkowanie potencjometryczne polega na rejestrowaniu zmian potencjału (SEM) elektrody wskaźnikowej spowodowanych dodaniem określonej objętości titranta z biurety, lub usuwaniem określonych jonów w trakcie miareczkowania. Na podstawie wykresu zależności SEM od objętości titranta określa się punkt końcowy miareczkowania (PK) i wyznacza poszukiwaną wartość np. stężenia.
Parametr roztworu elektrolitu pochodny od stężenia jonów hydroniowych (H3O+) w roztworze. Jego ścisła definicja ulega ciągłym ewolucjom, w praktyce określamy pH jako logarytm dziesiętny z odwrotności wartości stężenia molowego jonów wodorowych (hydroniowych).
9. Pojęcie pojemnośći buforowej
Każdy bufor posiada swoją pojemność, zwaną pojemnością buforową β, która jest warunkowana stałą równowagi głównej reakcji buforowej, oraz stężeniem czynnika słabo dysocjującego. Na przykład jeśli do roztworu bufora złożonego ze słabego kwasu i jego soli, dodamy tyle silnej zasady, że spowoduje ona całkowitą dysocjację słabego kwasu, w reakcji to dalsze dodawanie tej zasady spowoduje już taką zmianę pH jaka by następowała bez obecności bufora. Pojemność buforowa zależy od ogólnego stężenia kwasu i jego soli. Maksymalna pojemność wzrasta wraz z ogólnym stężeniem i nie zależy od mocy kwasu.
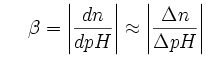
Pojemność buforowa zdefiniowana jest jako:
gdzie:Δn - ilość moli dodanego mocnego kwasu lub zasady (w praktyce podaje się dla 1 dm³ bufora, (Δn/V)) ΔpH - zmiana pH wywołana dodaniem tej ilości kwasu lub zasady
Pojemność buforowa (jej wartość jest zależna od pH) określa więc wrażliwość określonej ilości roztworu na dodawanie mocnego kwasu lub zasady, np. zmiana pH o 0,01 w wyniku dodania 0,006 mola kwasu lub zasady oznacza β=0,6 mol.

