(1) ![]()
Miłosz Piwowarczyk 2002/2003
Wydział Metali Nieżelaznych
Gr. Metalurgia
Ćwiczenie nr 10.
Temat: Współczynnik podziału - prawo Nernsta
Zespół 10
Wstęp teoretyczny:
Substancja rozpuszczana w dwóch pozostających w równowadze za sobą fazach (np. dwie nie mieszające się ze sobą ciecze) ulega rozdziałowi pomiędzy te fazy. W określonej temperaturze stosunek stężeń tej substancji w obydwu fazach jest wielkością stałą. Jest to prawo podziału i prawo Nernsta. Można je zapisać:
(1) ![]()
gdzie: r jest współczynnikiem podziału
Prawo podziału Nernsta stosuje się w tej formie w roztworach rozcieńczonych, w przypadku gdy stan cząstkowy substancji jest jednakowy w obydwu fazach. Jednak może wystąpić przypadek substancji, która w jednej z faz ulega silnej asocjacji, a w drugiej zaś pozostaje w stanie zdysocjowanym. W takim przypadku w każdej z faz ustala się równowaga asocjacyjno-dysacjacyjna. Zakładając w fazie I silne przesunięcia równowagi w kierunku dysocjacji w fazie II można napisać w przybliżeniu:
CA n I ≈ CII oraz CA II ≈ C II
nA An Faza I
nA An Faza II
Gdzie CI oraz CII oznaczają analityczne określenia stężenia substancji bez uwzględnienia asocjacji i dysocjacji. Stany równowagi w poszczególnych fazach charakteryzują odpowiednie stałe
(2) 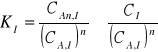
(3) 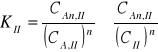
Gdy Substancja rozpuszczona ulega częściowej dysocjacji lub asocjacji prawo podziału zachowuje ważność dla ułamka substancji występującej w tym samym stanie cząsteczkowym w obydwu fazach
(4) 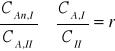
Dążymy do zastąpienia w równaniu (4) trudnej do wyznaczenia doświadczalnego wartości CA,I, przez łatwą do analitycznego wyznaczenia wartości CI. W tym celu przekształca się równanie (2)
(5) 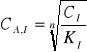
Wstawiając równanie (5) do (4) otrzymujemy:
(6) 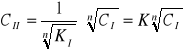
Lub w dogodnej dla doświadczalnego wyznaczenia postaci:
(7) ![]()
Cel ćwiczenia:
Celem ćwiczenia jest doświadczalne wyznaczenie współczynnika podziału kwasu octowego pomiędzy wodę i butanol oraz sprawdzenie, czy w obydwu fazach kwas benzoesowy występuje w tym samym stanie cząsteczkowym, a jeżeli nie to w jakiej postaci cząsteczkowej rozpuszcza się w poszczególnych fazach.
Oblicznia:
Wyniki oznaczeń współczynnika podziału kwasu octowego między wodę i alkohol butylowy NaOH 0,1n V = 5ml |
c but [mol/l] |
współczynnik podziału r |
|||||
Nr próbki |
c kwasu [mol/l] |
obj. NaOH [ml] |
c roztworu wodnego [mol/l] |
|
|
||
|
|
1 |
2 |
średnia |
|
|
|
1 |
0,05 |
1,1 |
1,2 |
1,15 |
0,023 |
0,027 |
0,852 |
2 |
0,1 |
2,1 |
2,1 |
2,1 |
0,042 |
0,058 |
0,724 |
3 |
0,25 |
5,5 |
5,6 |
5,55 |
0,111 |
0,139 |
0,799 |
4 |
0,5 |
11,4 |
11,5 |
11,45 |
0,229 |
0,271 |
0,845 |
5 |
0,75 |
17,2 |
17,1 |
17,15 |
0,343 |
0,407 |
0,843 |
6 |
1 |
23,9 |
23,5 |
23,7 |
0,474 |
0,526 |
0,901 |
|
|
|
|
|
|
średni: |
0,827 |
Wykres zależności Cw = f(Cb)
Z analizy wynika że zależność stężenia kwasu octowego w wodzie, od stężenia w butanolu jest zależnością liniową. Dla dużych rozcieńczeń jednak możemy zaobserwować odstępstwo od tego - wynikać to może z niedokładnego zmiareczkowania jak i błędu rozcieńczenia. Średnia wartość Cw/Cb dla naszego doświadczenia wynosi 0,827.
Obliczenia dla serii Nernsta i Smitha:
Stężenia kwasu benzoesowego w będących ze sobą w równowadze roztworach wodnych i benzenowych |
|||||
Stężenia w wodzie Cw |
log Cw |
Stężenie w benzenie Cb |
log Cb |
||
[mol/l]* 103 |
[g/l] |
|
[mol/l]* 103 |
[g/l] |
|
Wyniki Nernsta otrzymane w t0 = 200C |
|||||
1,34 |
0,163 |
0,126 |
4,385 |
0,535 |
0,642 |
2,00 |
0,244 |
0,301 |
8,115 |
0,99 |
0,909 |
3,70 |
0,452 |
0,569 |
22,377 |
2,73 |
1,350 |
6,46 |
0,788 |
0,810 |
60,410 |
7,37 |
1,781 |
12,30 |
1,5 |
1,090 |
198,361 |
24,2 |
2,297 |
23,69 |
2,89 |
1,375 |
795,082 |
97 |
2,900 |
Wyniki Smitha otrzymane w t0 = 250C |
|||||
0,8725 |
0,106 |
-0,059 |
1,525 |
0,186 |
0,183 |
0,925 |
0,113 |
-0,034 |
1,95 |
0,238 |
0,290 |
1,3 |
0,159 |
0,114 |
3,45 |
0,421 |
0,538 |
1,725 |
0,210 |
0,237 |
5,5 |
0,671 |
0,740 |
2,8 |
0,342 |
0,447 |
11,9 |
1,452 |
1,076 |
4 |
0,488 |
0,602 |
19,75 |
2,410 |
1,296 |
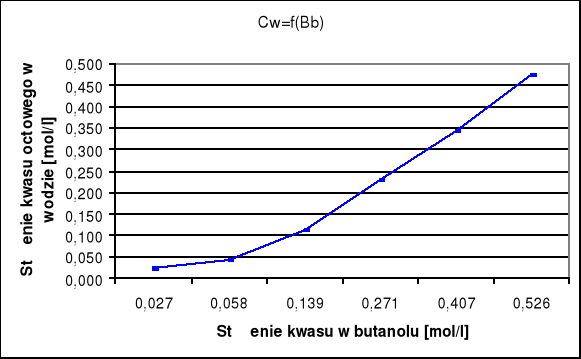
Wykresy zależności Cw = f (Cb):
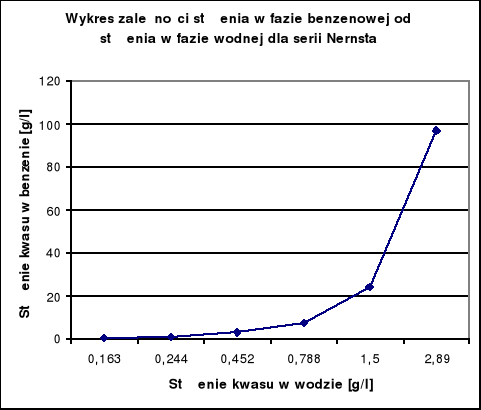
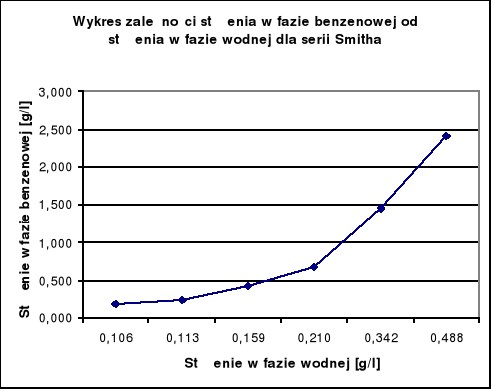
Wykresy te nie są liniowe czyli istnieje różnica stanu cząsteczkowego w obydwu fazach. W związku z tym sporządzam wykresy log cw = f (log cb) dla wyników Nernsta i Smitha.
Wykresy zależności log Cw = f (log Cb):
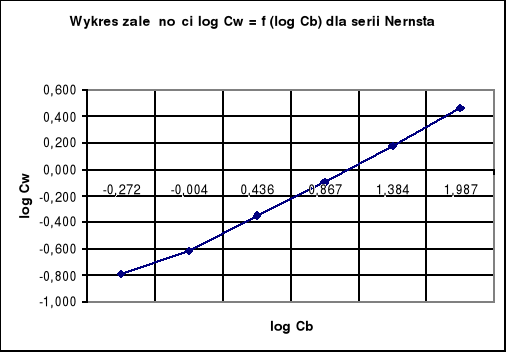
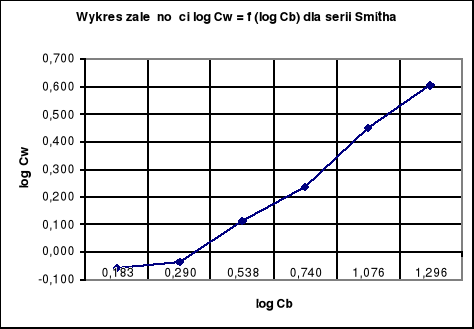
Wykresy log cw = f (log cb) dla wyników Nernsta i Smitha - obydwie zależności po zlogarytmizowaniu są liniowe, czyli możemy zastosować wzór ![]()
i obliczyć liczbę „n” cząstek tworzących kompleks (C6H5COOH)n dla obydwu przypadków.
Obliczanie wartości „n” dla serii Nernsta.
![]()
![]()
![]()
![]()
![]()
n=1,924 ≈ 2
Obliczanie wartości „n” dla serii Smitha:
![]()
![]()
![]()
![]()
![]()
n = 1,883 ≈ 2
Wnioski:
Pierwsza część doświadczenia udowodniła słuszność prawa Nernsta wykresy zależności Cw = f (Cb) są liniowe, a średni współczynnik podziału Cw/Cb wynosi 0,894 .
Dla wyników pomiarów Nernsta i Smitha zależność ta ma charakter nieliniowy. Liniowość otrzymujemy dopiero po zlogarytmizowaniu danych. Na podstawie naszych obliczeń możemy stwierdzić że badane substancje nie były w tym samym stanie cząsteczkowym. Więc z przeprowadzonych obliczeń możemy przypuszczać że utworzył się związek kompleksowy (C6H5COOH)2 .