Wydział IMiC |
Wykonujący: Maciej Skrzypek Przemysław Pudlik Michał Proć
|
Rok II |
Grupa 6 |
Zespół A |
|
Laboratorium Chemii Fizycznej |
TEMAT: Katalityczny rozkład wody utlenionej |
Ćwiczenie: 10 |
|||
Data wykonania:
|
Data oddania: |
Data zaliczenia: |
Ocena: |
||
Cel ćwiczenia.
Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji rozkładu wody H2O2 w obecności różnych ilości katalizatora (MnO2) oraz w roztworze bez katalizatora.
Przyrządy i odczynniki.
Do ćwiczenia wykorzystano:
30% roztwór H2O2 (perhydrol)
bufor boranowy
1M H2SO4
0,02M KMnO4
Szkło laboratoryjne (erlenmajerki, pipety o różnej objętości, kolba miarowa 50cm3)
Wykonanie ćwiczenia.
Do kolby miarowej 50 cm3 wlać 10 cm3 perhydrolu (30% wag. Roztwór H2O2) i dopełnić do kreski wodą destylowaną.
Do czterech kolb wlać:
100 cm3 wody destylowanej
30 cm3 buforu boranowego (0,2M H3BO3 i 0,05M Na2B4O7 w stosunku 9:1 w sumie dający ilość 120 cm3)
5 cm3 roztworu H2O2 przygotowanego wcześniej
roztwór KMnO4 o stężeniu 0,02M jako katalizator w ilości (1-10 cm3, 2-8 cm3,
3-5 cm3, 4-0 cm3)
Miareczkowanie:
Do erlenmajerki dodać 10 cm3 roztworu przygotowanego wcześniej oraz 2 cm3 1M H2SO4.
Miareczkowanie wykonywać w przedziale czasowym:
co 5 min. przez 30 min.
co 5 min. przez 30 min.
co 5 min. przez 40 min.
co 20 min. przez 120 min.
Opracowanie wyników:
Wyniki miareczkowań zebrano w tabelach poniżej.
Tabela1
Objętość roztworu katalizatora [cm3] |
czas |
VKMnO4 [cm3] |
ln VKMnO4 |
|
t [min] |
|
|
10 |
0 |
6,3 |
1,84 |
|
5 |
2,9 |
1,06 |
|
10 |
1,5 |
0,41 |
|
15 |
0,7 |
-0,36 |
|
20 |
0,4 |
-0,92 |
|
25 |
0,2 |
-1,61 |
|
30 |
0,1 |
-2,30 |
Tabela 2
Objętość roztworu katalizatora [cm3] |
czas |
VKMnO4 [cm3] |
ln VKMnO4 |
|
t [min] |
|
|
8 |
0 |
12,3 |
2,51 |
|
5 |
5,2 |
1,65 |
|
10 |
2,2 |
0,79 |
|
15 |
0,9 |
-0,11 |
|
20 |
0,4 |
-0,92 |
|
25 |
0,2 |
-1,61 |
|
30 |
0,1 |
-2,30 |
Tabela 3
Objętość roztworu katalizatora [cm3] |
|
VKMnO4 [cm3] |
ln VKMnO4 |
|
czas |
|
|
|
t [min] |
|
|
5 |
0 |
11,4 |
2,43 |
|
5 |
9,2 |
2,22 |
|
10 |
7,2 |
1,97 |
|
15 |
5,9 |
1,77 |
|
20 |
4,4 |
1,48 |
|
25 |
3,4 |
1,22 |
|
30 |
2,6 |
0,96 |
|
35 |
1,8 |
0,59 |
|
40 |
1,3 |
0,26 |
Tabela 4
Objętość roztworu katalizatora [cm3] |
|
VKMnO4 [cm3] |
ln VKMnO4 |
|
czas t [min] |
|
|
0 |
0 |
13,4 |
2,60 |
|
20 |
13,3 |
2,59 |
|
40 |
13,2 |
2,58 |
|
60 |
13,2 |
2,58 |
|
80 |
13,1 |
2,57 |
|
100 |
13,1 |
2,57 |
|
120 |
13 |
2,56 |
Na podstawie tych wyników sporządziliśmy wykres zależności ln(VKMnO4) od czasu:
Rys 1.
Stałe szybkości reakcji k wyznaczone z nachylenia wykresów (a= -k):
roztwór z 10 cm3 KMnO4: y = -0,136x + 1,778 ![]()
roztwór z 8 cm3 KMnO4: y = -0,161x + 2,429 ![]()
roztwór z 5 cm3 KMnO4: y = -0,053x + 2,512 ![]()
roztwór z 0 cm3 KMnO4: y = -0,00023x + 2,593 ![]()
Jako że jest to reakcja rzędu pierwszego więc τ ½ możemy obliczyć ze wzoru:
τ ½![]()
(1)
Czasy połowicznej przemiany τ ½ dla kolejnych roztworów:
roztwór |
Vkat [cm3] |
k[1/min.] |
τ½ [min.] |
I |
10 |
0,136 |
5,10 |
II |
8 |
0,161 |
4,31 |
III |
5 |
0,053 |
13,08 |
IV |
0 |
0,00023 |
3013,68 |
Następnie sporządziliśmy wykres zależności objętości KMnO4 od ilości katalizatora po 20 minutach:
Rys 2.
Następnie sporządziliśmy wykres zależności stałej szybkości reakcji od ilości katalizatora:
Rys. 3.
Wyniki obliczeń stężenia H2O2 zebrano w poniższych tabelach:
![]()
(2)
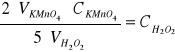
(3)
Tabela 5
Objętość rotworu katalizatora [cm3] |
czas |
VKMnO4 [cm3] |
C H2O2 [mol/dm3] |
|
t [min] |
|
|
10 |
0 |
6,3 |
0,01008 |
|
5 |
2,9 |
0,00464 |
|
10 |
1,5 |
0,00240 |
|
15 |
0,7 |
0,00112 |
|
20 |
0,4 |
0,00064 |
|
25 |
0,2 |
0,00032 |
|
30 |
0,1 |
0,00016 |
Tabela 6
Objętość rotworu katalizatora [cm3] |
czas |
VKMnO4 [cm3] |
C H2O2 [mol/dm3] |
|
t [min] |
|
|
8 |
0 |
12,3 |
0,01968 |
|
5 |
5,2 |
0,00832 |
|
10 |
2,2 |
0,00352 |
|
15 |
0,9 |
0,00144 |
|
20 |
0,4 |
0,00064 |
|
25 |
0,2 |
0,00032 |
|
30 |
0,1 |
0,00016 |
Tabela 7
Objętość rotworu katalizatora [cm3] |
|
VKMnO4 [cm3] |
|
|
czas |
|
C H2O2 [mol/dm3] |
|
t [min] |
|
|
5 |
0 |
11,4 |
0,01824 |
|
5 |
9,2 |
0,01472 |
|
10 |
7,2 |
0,01152 |
|
15 |
5,9 |
0,00944 |
|
20 |
4,4 |
0,00704 |
|
25 |
3,4 |
0,00544 |
|
30 |
2,6 |
0,00416 |
|
35 |
1,8 |
0,00288 |
|
40 |
1,3 |
0,00208 |
Tabela 8
Objętość rotworu katalizatora [cm3] |
|
VKMnO4 [cm3] |
C H2O2 [mol/dm3] |
|
czas t [min] |
|
|
0 |
0 |
13,4 |
0,02144 |
|
20 |
13,3 |
0,02128 |
|
40 |
13,2 |
0,02112 |
|
60 |
13,2 |
0,02112 |
|
80 |
13,1 |
0,02096 |
|
100 |
13,1 |
0,02096 |
|
120 |
13 |
0,02080 |
Następnie sporządziliśmy wykresy zależności objętości KMnO4 od stężenia H2O2 :
Rys 4.
Rys 5
Rys 6
Rys 7
Ostatnią czynnością było sporządzenie wykresu zależności stężenia H2O2 od czasu:
Rys 8
Wnioski:
Rysunek 1.
Przedstawia zależność ln(V KMnO4) od czasu. Jak widzimy dla roztworu bez dodatku katalizatora wykres przyjmuje wartość stałą oscylującą wokół 3. Natomiast dla innych roztworów mamy do czynienia z funkcją malejącą.
Rysunek 2.
Przedstawia zależność użytego podczas miareczkowania KMnO4 od ilości katalizatora po czasie 20 minut.
Rysunek 3.
Przedstawia zależność stałej szybkości reakcji od ilości katalizatora. Jak widzimy wraz ze wzrostem ilości dodanego katalizatora stała szybkości reakcji wzrasta, co świadczy o tym że katalizator zwiększa szybkość reakcji, w przypadku 8 cm3 katalizatora obserwujemy odstępstwo od tego i stała szybkości tej reakcji jest większa niż dla 10 cm3. Należy również zauważyć że wraz ze wzrostem stałej szybkości reakcji maleje czas połowicznego rozpadu.
Rysunki 4,5,6,7.
Przedstawiają zależność objętości KMnO4 stężenia H2O2. Jak widzimy wszystkie wykresy są zależnościami liniowymi w których wraz ze wzrostem stężenia H2O2 wzrasta objętość KMnO4.
Rysunek 8.
Ostatni wykres przedstawia zależność stężenia H2O2 od czasu. Jak widzimy dla roztworów z dodatkiem katalizatora stężenie spada wraz z czasem, natomiast dla roztworu bez dodatku katalizatora pozostaje praktycznie bez zmian.