51. 0-wa zasada termodynamiki
Dwa układy, które pozostają w równowadze termicznej, mają tę samą temperaturę.
Temperatura jest miarą zdolności do transportu ciepła.
TEMPERATURA = “stan ciepłoty, gorąca”
Wolno poruszające się atomy lub cząsteczki maja niską temperaturę.
Szybko poruszające się atomy lub cząsteczki maja wysoką temperaturę.
Skale temperatur
Używaną na co dzień skalą temperatur jest skala Celsjusza(0C).
Absolutną termodynamiczną skalą odpowiadającą skali Celsjusza jest skala Kelvina(K).
Inną skalą jest skala Farenheita( 0F), dla której skalą absolutną jest skala Rankine'a( 0R).
Dla skali Kelvina i Rankine'a zero absolutne jest takie same; -273.15 0C.
Zbiornik umieszczamy w miejscu, w którym mierzymy temperaturę. Odczytujemy ciśnienie. Następnie umieszczamy zbiornik w temperaturze wzorcowej i odczytujemy ciśnienie pwz.
52.
Pojemność cieplna
Różniczkowa ilość ciepła zaabsorbowanego przez układ (dQ), niezbędna do zmiany temperatury układu jest proporcjonalna do tej zmiany temperatury (dT)
Współczynnik proporcjonalności C jest zwany pojemnością cieplną układu
Jeśli pojemność cieplna nie zależy od temperatury to : ΔQ = C ⋅ ΔT
Ciepło właściwe i ciepło molowe
Pojemność cieplna układu jest proporcjonalna do ilości materii w układzie i jej rodzaju.
Jeśli ilość materii wyraża się przez masę (m):
![]()
Gdzie c jest ciepłem właściwym
![]()
Jeśli ilość materii jest wyrażona przez liczbę moli (n),
![]()
gdzie Cm jest molowym ciepłem właściwym
Liczba moli
n- liczba moli
m- masa substancji
M- masa molowa
NA liczba Avogadro
N- liczba cząsteczek
NA= 6.022045 1023 cz/g.mol
53.
Gaz doskonały
Definicja makroskopowa : Gaz doskonały to taki, który spełnia równanie stanu
54.
Proces odwracalny jest to proces który może przebiegać w obydwie strony nieskończenie długo bez strat.
Proces nieodwracalny jest to taki w którym mamy do czynienia ze stratą energii.
Przyczynami takich strat mogą być:
Tarcie, spadki napięcia, temperatury, ciśnienia i stężenia.
Proces adiabatyczny -pod czas którego wyizolowany układ nie nawiązuje wymiany ciepła, całość energii jest dostarczana lub odbierana z niego jako praca.
![]()
(prawo Poissona)
Krzywa czerwona i zielona - przemiana izotermiczna, niebieska - adiabatyczna
Izoprocesy
Izotermiczny (prawo Boyle-Mariott'a)
![]()
Izobaryczny (prawo Charles'a i Gay-Lussac'a )
![]()
Izochoryczny
![]()
55.
Praca makroskopowa
Kiedy objętość układu zmienia się to układ wykonuje pracę ( makroskopową).
56.
I zasada termodynamiki
Dla każdego procesu termodynamicznego, różnica miedzy ciepłem dostarczonym do układu a pracą wykonaną przez układ zależy tylko od początkowego i końcowego stanu układu.
Istnieje funkcja stanu, zwana energią wewnętrzną, taka, że
dU = dQ - dW
gdzie dQ jest ciepłem dostarczonym do układu a dW jest pracą wykonaną przez układ.
Uwaga: W skali mikroskopowej, energia wewnętrzna układu jest całkowitą energią mechaniczną układu.
57.
Zmiany energii wewnętrznej
proces adiabatyczny - ciepło nie jest przekazywane
ΔU = ΔW (dU = -dW)
proces izobaryczny - stałe ciśnienie
ΔU = ΔQ - ΔW (dU = dQ - dW)
proces izotermiczny - stała temperatura
ΔU = ΔQ - ΔW (dU = dQ - dW)
(dla gazu idealnego dU = 0
proces izochoryczny - stała objętość
ΔU = ΔQ (dU = dQ)
proces cykliczny - układ wraca do stanu wyjściowego ΔU = 0
58.
Aby pokazać proste zależności pomiędzy termodynamiką mikroskopową a makroskopową rozważmy prostą kinetyczną analizę cząsteczek gazu. Ciśnienie jest zdefiniowane jako siła wywierana na ściankę przez uderzające w nią cząsteczki.
Pęd przekazany ściance przez każdą cząstkę jest równy.
![]()
Liczba molekuł uderzająca powierzchnię dA dana jest przez strumień molekuł w kierunku z
![]()
![]()
jest gęstością molekularną, czyli liczbą molekuł na jednostkę objętości.
Jeśli założymy przypadkowy ruch molekuł, to tylko połowa molekuł poruszać się będzie w kierunku -z .
![]()
Z zależności pomiędzy popędem siły a zmianą pędu znajdujemy, że całkowity pęd przekazany powierzchni dA w czasie dt jest równy iloczynowi
![]()
Czyli ![]()
Wiemy, że 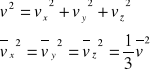
Otrzymujemy ![]()
![]()
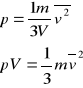
Porównując to równanie z równaniem gazu doskonałego otrzymujemy:
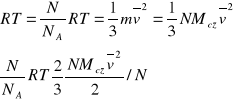
![]()
Temperatura jest miarą średniej energii kinetycznej gazu.
59.
![]()
![]()
60.
![]()
B
C
A
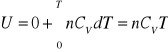
TA=TC
B
Jeśli nie ma przepływu ciepła między A i B oraz B i C, to nie będzie
też między A i C.
Trzy różne kawałki
materii. Każdy ma
przewodzące brzegi.
A
C
C
B
A
Jeśli energia wewnętrzna w T=0K jest równa zeru, to
0F = 32.0 + 9/5 0C
0R = 0F +459.67
K = 0C + 273.15
0R = 9/5 K
a
P
b
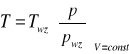
nieznana T
ciśnienie
V
objętość
Termometr gazowy
T
![]()
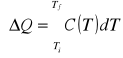
![]()
![]()
![]()
V
p
vz
T
dx
V3<V2< V1
![]()
dA
vy
V
![]()
T
![]()
P3<P2< P1
![]()
T1< T2<T3
p
V
![]()
![]()
![]()
![]()
Z I zasady termodynamiki dla procesu izochorycznego:
dU = dQ = nCVdT
![]()
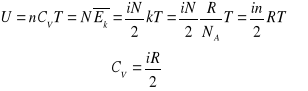
vx
z
y
x
![]()
Wyszukiwarka
Podobne podstrony:
Zagadnienia na egzamin, PWR - Automatyka i Robotyka W10, Semestr 1, air
wynikiI, PWR - Automatyka i Robotyka W10, Semestr 1, air
Wyklad10ALG2001, PWR - Automatyka i Robotyka W10, Semestr 1, air
opr zadan, PWR - Automatyka i Robotyka W10, Semestr 1, air, materialy, Nowy folder
lista 1 i 2, PWR - Automatyka i Robotyka W10, Semestr 1, air
sciagaCAM - odlewnictwo, PWR - Automatyka i Robotyka W10, semestr 4, Obróbka bezubytkowa1, Odlewnict
Odlewnictwo sciaga, PWR - Automatyka i Robotyka W10, semestr 4, Obróbka bezubytkowa1, ODLEDNICTWO1,
Odlewnictwo Janus Zestaw1, PWR - Automatyka i Robotyka W10, semestr 4, Obróbka bezubytkowa1, Odlewni
sylabus mikroekonomia, PWR - Automatyka i Robotyka W10, Semestr 1, Mikroekonomia
Odlewnictwo wyk1, PWR - Automatyka i Robotyka W10, semestr 4, Obróbka bezubytkowa1, ODLEDNICTWO1, od
aspec wyklad234, PWR - Automatyka i Robotyka W10, semestr 4, Podstawy automatyki, Podstawy Automatyk
Regulatory, PWR - Automatyka i Robotyka W10, semestr 4, Podstawy automatyki
SPRAWOZDANIE PARAMETRY, PWr, Automatyka i Robotyka, II semestr, Miernictwo 2, Laboratorium
L.2 Zasady drgania, PWr, Automatyka i Robotyka, II semestr, Fizyka 1.1A Radosz, Ćwiczenia
Półprzewodniki ZENER SPRAWKO, PWr, Automatyka i Robotyka, II semestr, Fizyka 3.3, Laboratoria
Przyklad Test, PWR, Automatyka i Robotyka (AIR), Semestr II, Fizyka 3.3, Wykład
automatyka i robotyka-rozwiazania, POLITECHNIKA, AiR, Semestr II, AUTOMATYKA I ROBOTYKA, KOLOKWIUM
ROPRM - Sprawozdanie ćw1 Symulator Manipulatora Kartezjańskiego, Automatyka i robotyka, Inzynierka,
opracowane15zagadnien profTchon lato07 by aman, PWr, Automatyka i Robotyka, V semestr, Robotyka
więcej podobnych podstron