Kinetyczno-cząsteczkowa teoria budowy materii
Kinetyczno cząsteczkowa teoria budowy materii zakłada, że:
10 - Wszystko co nas otacza, a także i my, zbudowane jest z materii, a cała materia składa się z mikroskopijnych cząstek - atomów. Atomy tego samego pierwiastka są identyczne pod względem wielkości i masy, natomiast atomy dwóch innych pierwiastków mają różną masę i wielkość. Rzadko się zdarza, aby występowały pojedynczo. Zwykle atomy łączą się ze sobą. Dwa lub więcej połączonych za sobą atomów tworzą molekuły. Mogą one istnieć samodzielnie. Atomy wchodzące w skład molekuły utrzymują się razem dzięki wiązaniom chemicznym. W dalszej części pracy zaprezentuję doświadczenie potwierdzające istnienie cząsteczek.
20 - Cząsteczki są w ciągłym, chaotycznym ruchu. Prędkość cząsteczek zależy od temperatury ciała. Im temperatura wyższa, tym poruszają się szybciej oraz odwrotnie. Poruszają się one od zderzenia do zderzenia, a ich odbicia są sprężyste.
30 - W przyrodzie występują siły, które przyciągają lub utrzymują cząsteczki w określonej odległości, czyli oddziaływania międzycząsteczkowe.
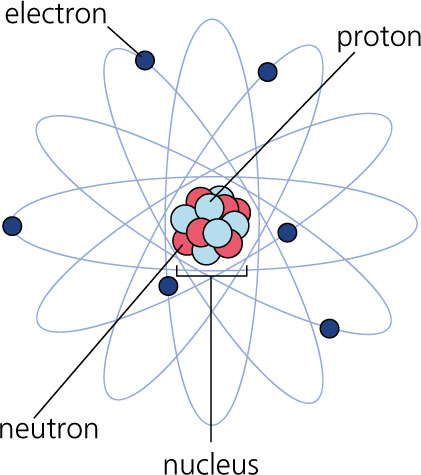
Atom to najmniejsza cząstka pierwiastka chemicznego, np. żelaza lub miedzi, zachowująca jego właściwości fizyczne i chemiczne. Uczeni rozróżniają atomy różnych pierwiastków na podstawie ich budowy. Atomy są budulcem wszelkiej materii we wszechświecie. W centrum każdego atomu znajduje się jądro, zbudowane z drobnych cząstek zwanych protonami i neutronami. Wokół jedna krążą inne cząstki - elektrony - utrzymywane w swym położeniu siłą ładunków elektrycznych. Układ protonów, neutronów i elektronów jest odmienny w atomach różnych pierwiastków. Atomy są zbyt małe, by dostrzec je gołym okiem, zastosowanie mikroskopu elektronowego umożliwiło jednak uczonym ich sfotografowanie. Wyglądają one jak rozmazane białe punkty. Jądro atomu jest 10000 razy mniejsze niż sam atom, elektrony zaś jeszcze mniejsze. W przyrodzie występują w postaci naturalnej 92 pierwiastki chemiczne, a zatem także 92 rodzaje atomów. Kilka pierwiastków otrzymano sztucznie w laboratoriach.
Cząsteczka, zwana też drobiną lub molekułą, jest najmniejszą trwałą ilością substancji (pierwiastka lub związku chemicznego), złożoną z co najmniej dwóch atomów, zdolną do samodzielnego istnienia i zachowującą właściwości fizyczne i chemiczne danej substancji. Każda cząsteczka danej substancji jest tak samo zbudowana: ma tę samą liczbę atomów, powiązanych ze sobą w identyczny sposób. Cząsteczki są maleńkie. W jednej łyżeczce wody zawiera się co najmniej tyle cząsteczek, ile łyżeczek wody w Oceanie Atlantyckim. Aby przekonać się o istnieniu cząsteczek wykonajmy doświadczenie:
Pomoce: dwa wysokie szklane naczynia, kasza (około 1/3 szklanki), groch (około 1/3 szklanki), dwie probówki, woda, spirytus etylowy (denaturat)
• Do jednej probówki wlejmy denaturat, do drugiej wodę do 1/3 ich wysokości.
• Bardzo ostrożnie przelejmy denaturat do probówki z wodą i zaznaczmy, do jakiego poziomu sięgają ciecze.
• Zatkajmy probówkę i energicznie potrząsając, wymieszajmy ciecze.
• Zaznaczmy poziom cieczy po wymieszaniu.
Obserwacja: W probówce powstała ciecz o jednolitym zabarwieniu. Jej poziom sięga niżej niż przed wymieszaniem obu składników. Jak wytłumaczyć obniżenie się poziomu cieczy? Jeżeli ciecze były przelewane i mieszane z należytą ostrożnością, nie możemy tłumaczyć obniżenia się poziomu mieszaniny ubytkiem płynu na skutek rozlania.
W wyjaśnieniu tego zjawiska pomoże doświadczenie modelowe:
• Do jednego szklanego naczynia wsypmy kaszę, do drugiego groch do 1/3 ich wysokości.
• Delikatnie przesypmy kaszę do naczynia z grochem i zaznaczmy poziom, do jakiego sięgają ziarna.
• Energicznie potrząsając naczyniem wymieszajmy kaszę z grochem i ponownie zaznaczmy poziom, do jakiego sięgają ziarna.
Obserwacja: Podczas potrząsania naczyniem drobniejsze ziarna kaszy wypełniły wolną przestrzeń między ziarnami grochu. Poziom kaszy z grochem w naczyniu obniżył się.
Poziom ziaren w naczyniu obniżył się, ponieważ wymieszane ziarna zajmuj ą mniejszą objętość niż każdy ich rodzaj z osobna. Zwróćmy uwagę na analogie widoczne w obu doświadczeniach - zarówno woda z denaturatem, jak i kasza z grochem po wymieszaniu zmniejszyły zajmowaną objętość. To spostrzeżenie pozwala nam przypuszczać, że woda i denaturat składaj ą się drobin, które podczas potrząsania upakowały się ciasno między sobą. Ziarenka kaszy i grochu można zaobserwować gołym okiem. Nie można natomiast gołym okiem, ani też przez mikroskop, zaobserwować cząsteczek wody czy denaturatu. Materia może przybierać postać ciał stałych, ciekłych i gazowych.
Takie też są stany skupienia. Ciała stałe mają kształt i objętość, a ich cząstki są mocno powiązane. Ciała ciekłe także mają objętość, ale są pozbawione kształtu - przybierają kształt naczynia, w którym się znajdują. Ze względu na luźniejsze powiązanie cząsteczek substancje 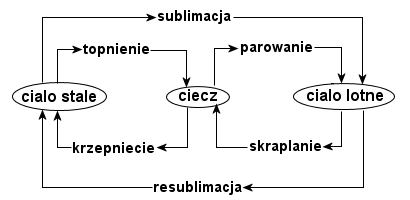
te są płynne. Gazy nie mają kształtu i objętości. Ich cząsteczki przemieszczają się swobodnie, więc ciała gazowe wypełniają każdą pustą przestrzeń. Wiele substancji stosunkowo łatwo zmienia stan skupienia pod wpływem temperatury. Woda jest cieczą, ale po ogrzaniu zmienia się w gaz (parowanie), po ochłodzeniu zaś - w ciało stałe (krzepnięcie). Podgrzany lód najpierw przechodzi w ciecz (topnienie), a następnie w parę wodną. Kiedy para wodna, pod wpływem oziębiania, staje się wodą mówimy o skraplaniu. Bezpośrednie przejście ze stanu stałego w gaz (krążki zapachowe) nazywamy sublimacją, natomiast przejście z gazu w ciało stałe - resublimacją.
Topnienie jest to rozluźnienie wiązań pomiędzy cząsteczkami pod wpływem ogrzewania. Ciało traci swój kształt, a cząsteczki danego ciała poruszają się coraz szybciej i odrywają się od siebie. Krzepnięcie polega na spowolnieniu ruchu cząsteczek. Łączą się one ze sobą i porządkują się w sieć krystaliczną.
Parowanie zachodzi wtedy, gdy cząsteczki cieczy, przy podgrzewaniu, zaczynają poruszać się coraz szybciej, a ich prędkość jest wystarczająco duża, i uwalniają się z cieczy. Uwolnione cząsteczki tworzą gaz, który wypełnia całą dostępną objętość naczynia. O skraplaniu mówimy, kiedy gaz zostaje oziębiony, a cząsteczki zaczynają poruszać się coraz wolniej, zaczynają zbliżać się do siebie i tworzy się ciecz.
Sublimacja jest to odrywanie się cząsteczek, ciała stałego, od siebie i ich szybkie poruszanie (tak jak w gazach). Resublimacja zachodzi wtedy, gdy cząsteczki gazu oziębią się na tyle mocno, że utworzą sieć krystaliczną.
Cząsteczki cieczy, jak i ciał stałych oraz gazów, są w nieustannym ruchu. Świadczą o tym dyfuzja i ruchy Browna. Dyfuzja jest to mieszanie się dwóch różnych, stykających się ze sobą cieczy, gazów lub ciał stałych. Zachodzi ona w wyniku ruchu cząsteczek. Natomiast ruchy Browna to chaotyczne ruchy maleńkich cząstek substancji wywołane bezwładnym ruchem cząsteczek środowiska otaczających te cząstki. Aby dowieść prawdziwości tych zjawisk prześledźmy doświadczenia:
Pomoce: szklanka z wodą, łyżeczka cukru.
• Do szklanki z ciepłą wodą wsypmy łyżeczkę cukru.
• Nie mieszając wody, po kilku minutach określmy jej smak.
Obserwacja: Woda jest słodka. Nie widać śladów cukru. Co spowodowało zmianę wyglądu i smaku zawartości szklanki?
Słodki smak wody świadczy o tym, że cukier rozprzestrzenił się w cieczy. Chaotycznie poruszające się cząsteczki wody zderzając się z bryłkami cukru, stopniowo je rozdrabniają na coraz mniejsze elementy, aż do najmniejszych drobin. Nieustanne zderzenia między cząsteczkami wody i cukru powodują, że cukier rozprzestrzenia się w całej objętości wody. Takie zjawisko nazywamy rozpuszczaniem. W wyniku rozpuszczania powstaje jednorodna przezroczysta ciecz, którą nazywamy roztworem. W każdej najmniejszej objętości roztworu znajdują się cząsteczki wody i cukru.
Pomoce: kryształki nadmanganianu potasu, szklanka z wodą.
• Do szklanki z wodą wrzućmy kilka kryształków nadmanganianu potasu.
• Obserwujmy, co dzieje się w szklance.
Obserwacja : Kryształki nadmanganianu potasu stają się niewidoczne. W ich miejsce pojawiaj się w wodzie ciemnofioletowe smugi. Woda stopniowo przybiera jednolitą różową barwę. Co spowodowało zmiany właściwości wody i nadmanganianu potasu?
Cząsteczki wody pozostają w nieustannym chaotycznym ruchu. Zderzając się z bryłkami nadmanganianu potasu wprawiają je w drgania, dzięki czemu cząsteczki nadmanganian potasu odrywają się od siebie i rozprzestrzeniają w wodzie. W efekcie woda zabarwia się na różowo.
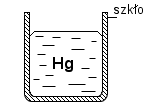
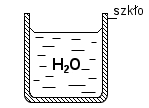
W przyrodzie występują oddziaływania cząsteczkowe. Wyróżniamy dwa typy tych oddziaływań: siły spójności i siły przylegania. Siłami spójności nazywamy wzajemne przyciąganie się cząsteczek tej samej substancji. Siły przylegania są to wzajemne przyciągania się cząsteczek różnych substancji. Jeżeli do probówki wlejemy wodę widzimy zakrzywienie, jak do uśmiechu, czyli menisk wklęsły. Natomiast jeżeli do probówki wlejemy rtęci to zaobserwujemy zakrzywienie w stronę przeciwną, czyli tzw. menisk wypukły. Z meniskiem wklęsłym spotykamy się, gdy siły spójności są mniejsze od sił przylegania, zaś z meniskiem wypukłym w sytuacji odwrotnej. Dowodem utwierdzającym nas w przekonaniu, że istnieją oddziaływania międzycząsteczkowe są poniższe doświadczenia:
Pomoce: dwie szybki (mogą być lusterka), woda.
• Połóżmy dwie szybki jedna na drugiej i rozdzielmy je.
• Zwilżmy jedną szybkę wodą, połóżmy ją na drugą i spróbujmy rozdzielić.
Obserwacja: Suche szybki można łatwo rozdzielić. Zwilżone - mocno do siebie przylegają i trudno je rozdzielić. Dlaczego woda utrudnia rozdzielenie szybek?
Wraz z pojawieniem się wody zwiększyło się przyleganie obu szklanych powierzchni, które utrudnia rozdzielenie szybek. Zjawisko przylegania spowodowane jest oddziaływaniem międzycząsteczkowym, które ma charakter elektromagnetyczny.
Pomoce: szklanka z wodą, ołówek.
• Do szklanki z wodą włóżmy ołówek.
• Obserwujmy powierzchnię wody wokół ołówka.
• Po chwili wyciągnijmy ołówek z wody i przyjrzyj się mu dokładnie.
Obserwacja: Powierzchnia wody wokół zanurzonego ołówka nieznacznie się podniosła. Po wyciągnięciu ołówka z wody pozostały na nim pojedyncze krople. Co utrzymuje krople na powierzchni ołówka?
Między cząsteczkami wody i ołówka występuje oddziaływanie powodujące przyleganie.
Podsumowując kinetyczno - cząsteczkowa teoria budowy materii jest jednym z podstawowych założeń fizycznych. Jest to teoria rozpatrująca budowę materii z punktu widzenia trzech założeń, które szczegółowo przedstawiłam we wstępie. Uogólniając je: materia jest zbudowana z drobin, cząsteczki są zawsze ruchu, występują oddziaływania międzycząsteczkowe. Teorię tą stworzył John Dalton - rozwiną myśl Demokryta, czym zasłużył się dla całej ludzkości.
Wyszukiwarka
Podobne podstrony:
Cząsteczkowa teoria budowy materii, ściagi za free
TEORIA KINETYCZNO MOLEKULARNA BUDOWY MATERII 1 , TEORIA KINETYCZNO MOLEKULARNA BUDOWY MATERII
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
referacik, Weterynaria UP lublin, I rok, Materiały, Ochrona środowiska, referaty prezentacje
Modele budowy materii
semestr 1, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
Ciecze izolacyjne - referat, dielektryki ciekle, Dielektryki izolatory materiały które bardzo słabo
Genetyka mendlowska, I prawo Mendla to podstawa korpuskularnej, czyli cząsteczkowej teorii dziedzicz
Inspiracja utworem... - referat, Politechnika Poznańska - Wydział Budowy Maszyn i Zarządzania, Mecha
Pytania organicza part I, Weterynaria UP lublin, I rok, Materiały, Chemia, koło organiczna
Ściaga długopis, Energia cieplna - energia kinetyczna drobin Energia wewnętrzna - suma energi kine
Fizyka-ściąga , Podstawowe równanie torii kinetyczno-cząsteczkowej gazu doskonałego
Objaśnienia do teorii budowy statku
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
więcej podobnych podstron