10. NAWILŻANIE I SUSZENIE POWIETRZA. PODSTAWOWE WŁASNOŚCI UKŁADU POWIETRZE - PARA WODNA. NAWILZANIE POWIETRZA - RÓWNANIE PSYCHROMERU. CHŁODZENIE WODY.
A) PODSTAWOWE WŁASNOŚCI UKŁADU POWIETRZE - PARA WODNA
WILGOTNOŚĆ POWIETRZA :
- Względna : 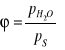
- gdzie ![]()
- prężność pary wodnej, ![]()
- prężność nasycona,
- Bezwzględna : 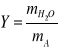
- masa pary wodnej przypadająca na masę 1 kg suchego powietrza
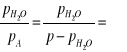
( bo ![]()
) 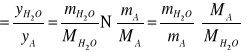
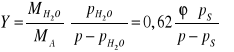
CIEPŁO WILGOTNE :
CA - ciepło właściwe, r - ciepło parowania wody, CH - ciepło wilgotne
![]()
, ![]()
, ![]()
,
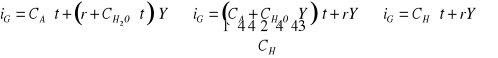
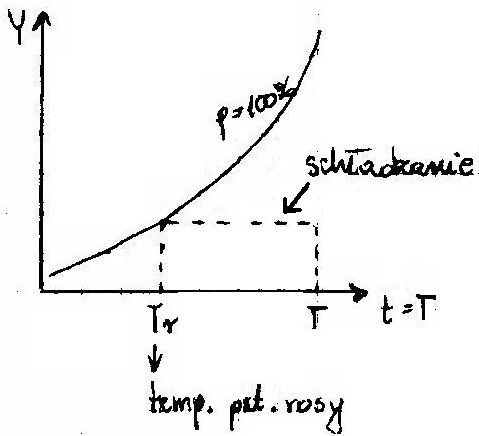
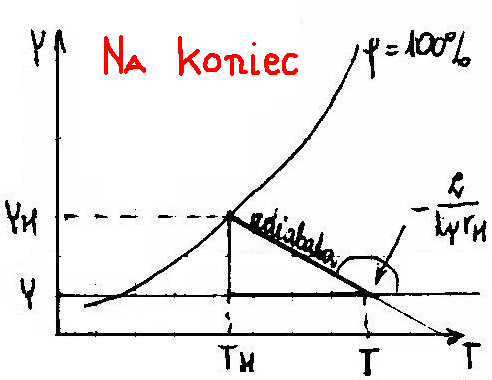
B) TEMPERATURA PUNKTU ROSY - Najwyższa temperatura przy której pojawia się pierwsza kropla.
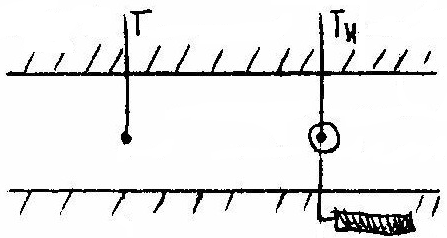
T - Termometr suchy
TH - Termometr mokry (wskaże niższą temperaturę )
![]()
ale ![]()
zatem :
![]()
![]()
![]()
- równanie mokrego termometru
![]()
gdzie :
![]()
- ciepło parowania wody
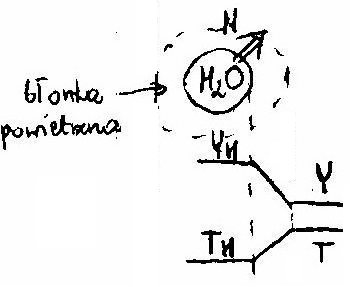
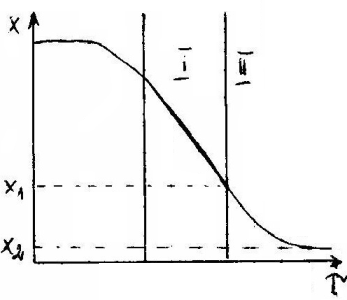
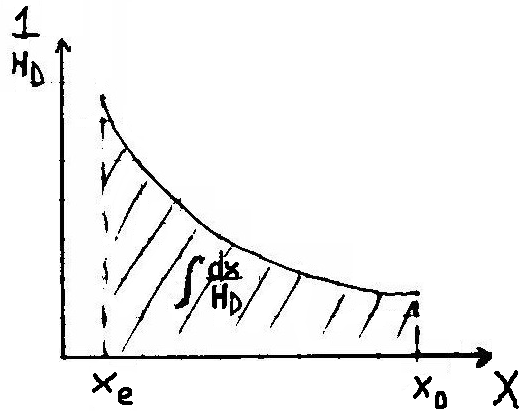
C) CHŁODZENIE WODY POWIETRZEM W WIERZY CHŁODNICZEJ
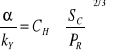
, ![]()
, ![]()
![]()
Temperatura H2O niższa niż temperatura powietrza które jest czynnikiem chłodzącym ![]()
11. SYSZENIE. RÓWNOWAGA SUSZARNICZA. KINETYKA SUSZENIA. OKRES STAŁEJ I ZMNIEJSZAJĄCEJ SIĘ SZYBKOŚCI SUSZENIA.
KINETYKA SUSZENIA
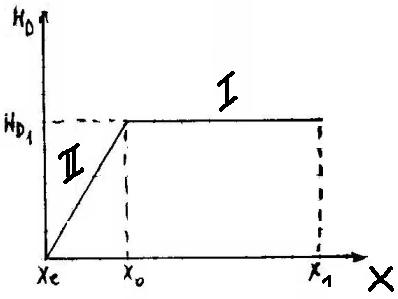
I - szybkość suszenia stała
II - szybkość suszenia spada
![]()
, ![]()
gdzie :![]()
- szybkość suszenia, dW - zmiana wilgotności w czasie ![]()
I Jeżeli szybkość suszenia jest stała równanie można scałkować
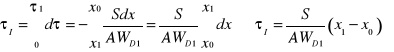
ale ![]()
zatem : 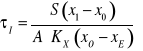
I Okres suszenia
![]()
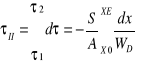
![]()
12. SZYBKOŚC REAKCJI HOMOGENICZNYCH. KINETYKA REAKCJI ENZYMATYCZNYCH (RODZAJE INHIBICJI), ENZYMY ALLOSTERYCZNE.
A) SZYBKOŚC REAKCJI
1. Szybkość objętościowa ( odniesiona do jednostki objętości) - zmiana ilości moli składnika w czasie
![]()
( T, p, składu)
Ubytek substratu w czasie : ![]()
, przyrost produktu w czasie : ![]()
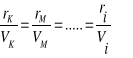
identycznie ale nie const.
2. Prawo działania mas Guldberga-Waage szybkość reakcji chemicznej jest proporcjonalna do stężenia reagentów.
![]()
gdzie N i M to rzędy reakcji
3. Stała szybkość reakcji zależy od temperatury
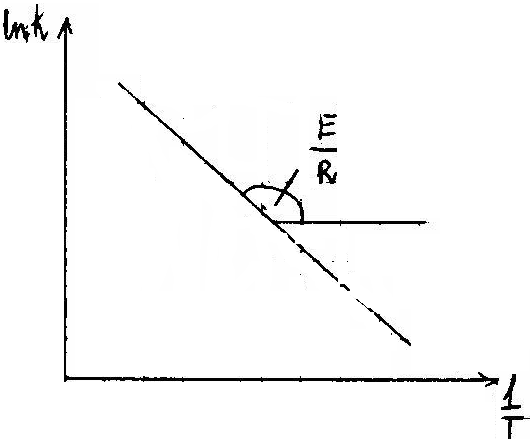
Równanie Arheniusa :
![]()
![]()
gdzie ![]()
K - stała szybkości reakcji, E - energia aktywacji, R - stała gazowa, T - temperatura bezwzględna
B) ENZYMY ALLOSTERYCZNE
np. Hemoglobina - składa się z 4 podjednostek, każda może przyłączyć substrat
![]()
, ![]()
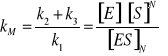
a stąd mamy : 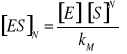
![]()
, ![]()
,
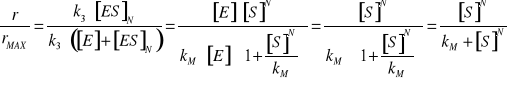
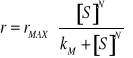
Równanie Hill'a. n - współczynnik kooperatywności.
C) RODZAJE INHIBICJII
1. INHIBICJA WSPÓŁZAWODNICZĄCA ( kompetycyjna) - inhibitor konkuruje z substratem o miejsce aktywne enzymu.
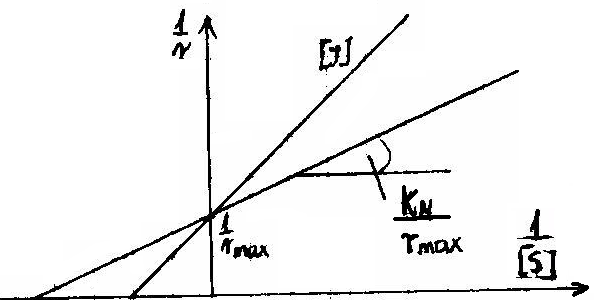
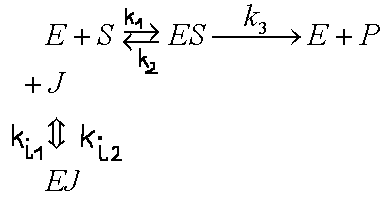
![]()
jest zmienne, ![]()
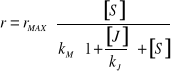
2. INHIBICJA NIEWSPÓŁZAWODNICZĄCA ( niekompetycyjna ) - inhibitor przyłącza się trwale, na stałe. Enzym posiada oddzielne miejsce do przyłączenia substratu i inhibitora, wiązanie jest niezależne.
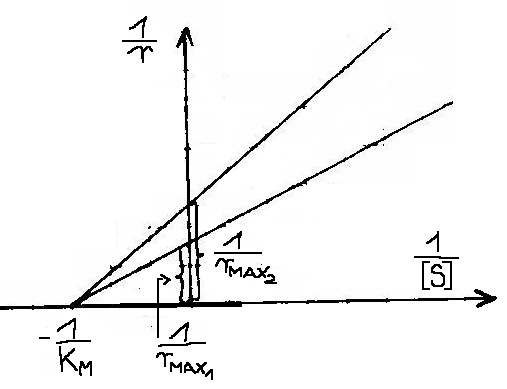
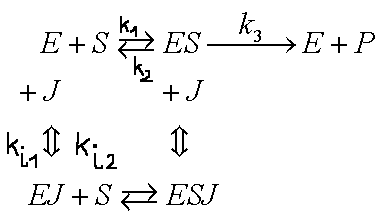
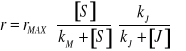
, gdzie ![]()
- stałe
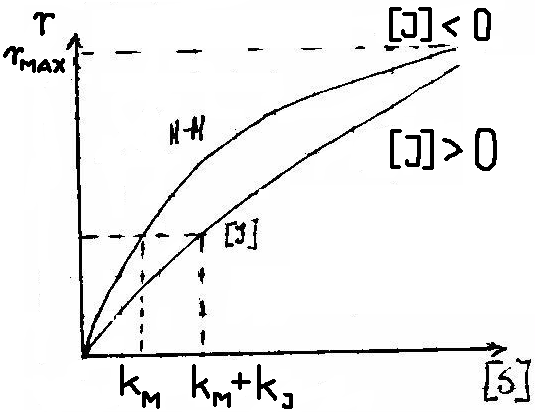
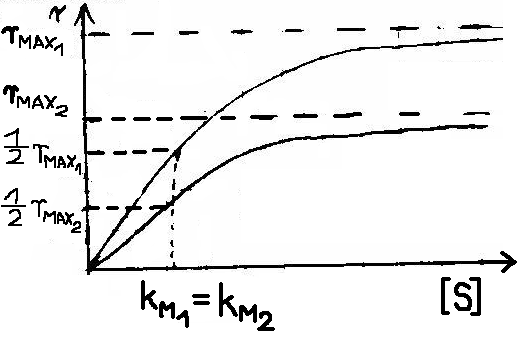
3. INHIBICJA AKOMPETYCYJNA - Inhibitor wiąże się tylko do kompleksu [ES] - zmianie ulega zarówno KM jak i rMAX
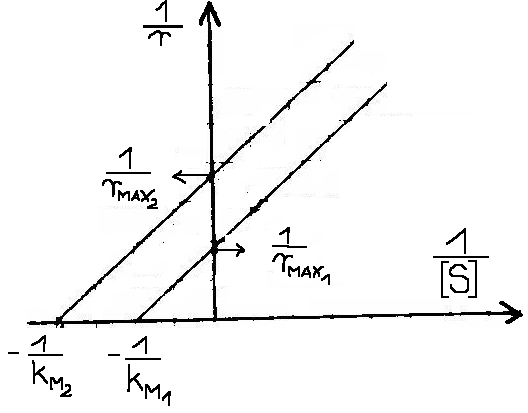
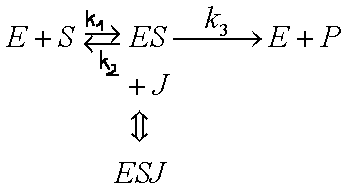
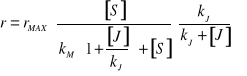
4. INHIBICJA SUBSTRATOWA - Cząsteczki substratu mogą się przyłączać nie tylko do centrum aktywnego, ale i do miejsc regulatorowych, co może powodować zmiany konformacji.
5. INHIBICJA PRODUKTEM - gdy powstaje za dużo produktu proces zostaje hamowany.
5
Wyszukiwarka
Podobne podstrony:
Ledaczek 2, MGR, sem I, Inżynieria Bioreaktorowa, Inzynieria, Inzynieria
chemia - poprawka - wszystkie zestawy - odpowiedzi, Inżynieria Środowiska [PW], sem 1, chemia, chemi
Tablica 7, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
sciaga inzynieria, WOiO, sem I, Inżynieria jakości
ochrona odpowiedzi do kolosa zaliczeniowego sem I, Inżynieria Środowiska Politechnika Śląska Rybnik,
kolo sem 6 inzynieryjna
Inżynieria komunikacyjna wykład 22.11.05, administracja, Reszta, rok III, sem 5, inzynieria komunu
Tablica 9, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
Tablica 6, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
charakterystyka pompy odśrodkowej, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM
Tablica 4, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
Tablica 5, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
Tablica 2, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
Przedworski Wojciech sprawozdanie pompy, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK I
Inżynieria - Ściąga, sem I, Inżynieria jakości i zarządzania środowiskiem, Inżynieria Jakości i Zarz
Sprawozdanie 25, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 3, INŻYNIERIA PRO
Tablica 1, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem, INZYNIERIA WYSOKONAPIECIOWA
Chemia sem I, Inżynieria Środowiska [PW], sem 1, chemia, chemia
SPRAWOZDANIE 10 MALORZATA USS, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 3,
więcej podobnych podstron