Analityka Medyczna - Egzamin - 2009-2010
Chemia organiczna
Budowa atomu węgla. Hybrydyzacja atomu węgla w związkach organicznych.
Sp3 W wyniku kombinacji orbitalu atomowego s i trzech orbitali atomowych p tworzą się cztery orbitale o hybrydyzacji sp3 (orbitale zhybrydyzowane). Hybrydy sp3 skierowane są ku narożnikom regularnego czworościanu. Ponieważ dwie pętle orbitali atomowych p maja różne znaki algebraiczne, mogą one połączyć się z orbitalem s albo w sposób addytywny, albo substraktywny, tworząc w ten sposób niesymetryczną hybrydę sp3 i nadając jej kierunek.
Wiązanie węgiel-węgiel tworzy się w wyniku nakładania się dwóch orbitali węgla o hybrydyzacji sp3.
Sp2 . Istnieją tutaj trzy równocenne orbitale zhybrydyzowane sp2, leżące w płaszczyźnie pod kątem 120o względem siebie oraz pojedynczy niezhybrydyzowany orbital p prostopadły do płaszczyzny sp2 . Nałożenie się orbitali dwóch atomów węgla o hybrydyzacji sp2 prowadzące do utworzenia wiązania podwójnego C═C. Jedna część wiązania podwójnego powstała w wyniku czołowego nałożenia się orbitali sp2, natomiast druga część utworzyła się w wyniku bocznego nałożenia się nie zhybrydyzowanych orbitali p. Wiązanie π zajmuje obszar gestości elektronowej po obydwu stronach linii łączącej jądra atomów węgla.
Sp. Dwa orbitale o hybrydyzacji sp znajdują się pod kątem 180o względem siebie, prostopadle do dwóch pozostałych orbitali p. Dwa atomy węgla o hybrydyzacji sp są połączone jednym wiązaniem σ sp-sp i dwoma wiązaniami π p-p
Kiedy mamy do czynienia z polaryzacją wiązania kowalencyjnego? Co znaczą pojęcia elektroujemność i efekt indukcyjny?
Płynne przejście od wiązania atomowego do wiązania jonowego jako wynik niesymetrycznego rozkładu elektronów. Grecki symbol δ oznacza cząstkowy ładunek, albo dodatni (δ +), albo ujemny (δ -)
Elektroujemność - właściwość atomu polegająca na zdolności przyciągania elektronów w wiązaniu atomowym. Metale (lewa strona ukladu okresowego) - przyciągają bardzo słabo elektrony i mają małą elektroujemność. Niemetale (prawa strona układu okresowego) - przyciągają silnie elektrony i maja dużą elektroujemność.
Efekt indukcyjny - przesunięcie elektronów w wiązaniu w odpowiedzi na elektroujemność sąsiadujących ze sobą atomów
Pojęcie kwasu i zasady wg Lewisa i Brönsteda. Podaj przykłady.
Kwasem Bronsteda jest substancja, która dostarcza protonu (kationu wodorowego H+), a zasadą jest substancja, która ten kation przyjmuje.
H-Cl + H-O-H <=> Cl- + H3O+
Kwas zasada sprzężona sprzężony
zasada kwas
(Kwas Lewisa) (zasada Lewisa)
Teoria ta obejmuje związki zawierające jony wodoru
Kwasem Lewisa jest substancja będąca akceptorem pary elektronowej, zaś zadadą jest substancja, która tej pary dostarcza. Rezultatem przeniesienia elektronu z zasady do kwasu jest utworzenie wiązania atomowego.
Teoria Lewisa nie ogranicza się do związków, które wymieniają protony.
W teorii Lewisa użyte zostają pary elektronowe.
Kwas Lewisa- akceptor par elektronowych
Zasada Lewisa- donor par elektronowych
Zasada Bronsteda = kwas Lewisa
Kwas Bronsteda ǂ zasada Lewisa (ale nie zawsze)
Różne kwasy Lewisa:
*różne obojętne donory protonu H2O HCl HBr HNO3 H2SO4
*różne kationy Li+ Mg2+ Br+
*różne związki metali AlCl3 BF3 TiCl4 FeCl3 ZnCl2
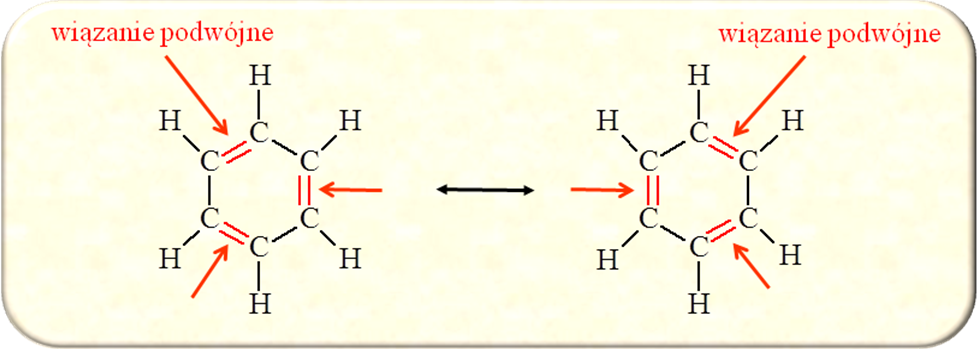
Co to są struktury rezonansowe? Zasady ich tworzenia, podaj przykłady.
*Indywidualne struktury rezonansowe nie są realne, lecz urojone.
*Struktury rezonansowe różnią się między sobą rozmieszczeniem elektronów π lub elektronów niewiążących.
*Struktury rezonansowe związku chemicznego nie muszą być równocenne
*Struktury rezonansowe muszą spełniać przyjęte zasady walencyjności

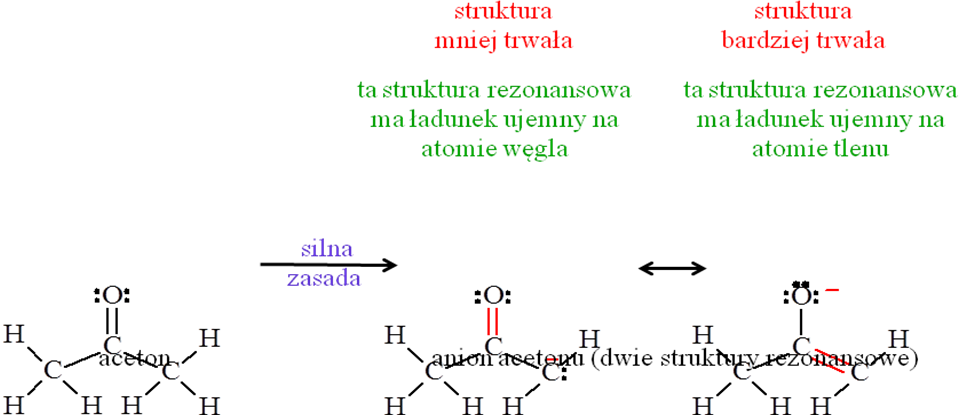
*Hybryda rezonansowa jest bardziej trwała niż jakakolwiek indywidualna struktura rezonansowa
Co oznaczają pojęcia nukleofil i elektrofil? Podaj przykłady.
NUKLEOFIL jest to indywiduum molekularne, które „lubi jądro” (czyli ładunek dodatni). W strukturze nukleofila znajduje się atom bogaty w elektrony, który może tworzyć wiązanie w wyniku dostarczenia pary elektronowej do atomu ubogiego w elektrony. Nukleofile są często, choć nie zawsze naładowane ujemnie.
ELEKTROFIL jest to indywiduum molekularne, które „lubi elektrony”. Elektrofil zawiera w swej strukturze atom ubogi w elektrony i może tworzyć wiązanie w wyniku przyjęcia (akceptacji) pary elektronów pochodzących od nukleofila. Elektrofile są często, choć nie zawsze naładowane dodatnio.
Podaj nazwy związków, których wzory podano niżej lub narysuj wzory związków, których nazwy podane są poniżej.
Mechanizm reakcji metanu z chlorem w obecności światła.
Inicjacja
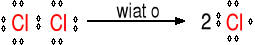
Wiązanie Cl─Cl ulega homolitycznemu rozpadowi pod wpływem światła
Propagacja
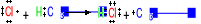
reakcje łańcuchowe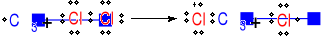
ciągłe powtarzanie się etapów a) i b)
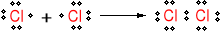
Terminacja
![]()
![]()
Możliwe etapy reakcji
Co oznacza pojęcie rzędowości atomu węgla? Podaj przykłady.
pierwszorzędowy atom węgla (1o) połączony jest z jednym innym atomem węgla
drugorzędowy atom węgla (2o) połączony jest z dwoma innymi atomami węgla
trzeciorzędowy atom węgla (3o) połączony jest z trzema innymi atomami węgla
czwartorzędowy atom węgla (4o) połączony jest z czterema innymi atomami węgla
Co to jest izomeria? Omów pojęcie i podaj przykłady.
Izomery są związkami, które mają ten sam wzór sumaryczny ale różne wzory strukturalne.
Izomery zawierają tę samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów..
Izomeria konstytucyjna:
Różne szkielety węglowe
Różne grupy funkcyjne
Różne położenie grup funkcyjnych
Stereo izomery (takie same połączenia ale różny układ przestrzenny)
W przypadku cykloalkanów rotacja wokół pojedynczego wiązania węgiel-węgiel jest znacznie trudniejsza niż w przypadku alkanów. Cyklopropan ma sztywną, płaską cząsteczkę. Niemożliwa jest żadna rotacja wokół wiązania węgiel-węgiel bez pękania wiązań tworzących pierścień.
Co oznaczają pojęcia rodnik i karbokation? Budowa i problem trwałości. Omów na przykładach.
Rodnik jest indywiduum molekularnym, które zawiera nieparzystą ilość elektronów walencyjnych i w ten sposób ma pojedynczy, niesparowany elektron na jednym ze swoich orbitali
Trwałość a rzędowość rodników: Siła wiązania maleje w szeregu: metan>1o>2o>3o.
Energia dysocjacji wiązania (D) jest określana jako ilość energii wymaganej do rozerwania wiązania w celu utworzenia dwóch fragmentów rodnikowych (faza gazowa, 25oC).
Trwałość rośnie ze wzrostem rzędowości.
Karbokation - jon z ładunkiem dodatnim zlokalizowanym na atomie węgla . Trwałość rośnie wraz z rzędowością
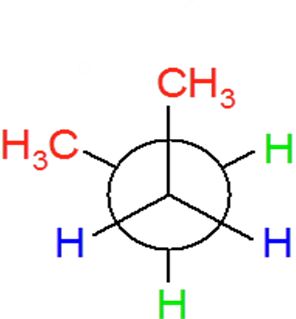
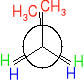
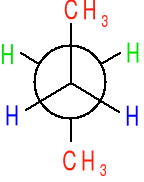
Pojęcie izomerów konformacyjnych na podstawie etanu i butanu.
Różne rozmieszczenie atomów w przestrzeni wynikające z rotacji wokół wiązania pojedynczego nosi nazwę konformacji, a konkretna względnie trwała konformacja nazywa się konformerem (izomerem konformacyjnym).
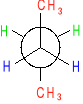
Układy konformacyjne cząsteczki etanu.
![]()
![]()
Szybki obrót zachodzacy wokół pojedynczego wiązania C-C wywołuje przejście między różnymi konformacjami.
konformacja naprzemianległa konformacja naprzeciwległa
Konformery naprzemianległe wykazują energię niższą o 12 kJ/mol od konformerów naprzeciwległych. Ilość 12kJ/mol dodatkowej energii charakterystycznej dla konformacji naprzeciwległej etanu nosi nazwę naprężenia torsyjnego (naprężenia występującego przy skręceniu.
Butan: Naprężenie steryczne to odpychające oddziaływanie, do którego dochodzi, gdy atomy zmuszone zostały do zbliżenia się do siebie bardziej niż pozwalają im na to ich promienie atomowe.
Antyperiplenarna synklinarna synperiplenarna
Najbardziej trwałą konformacją alkanu jest ta, w której wszystkie podstawniki są naprzemianległe, a wiązania węgiel-węgiel mają układ anti, jak pokazano to na przykładzie dekanu
Jaka jest przyczyna faktu, że pierścienie trój- i czteroczłonowe są mniej trwałe w porównaniu z pięcio- i sześcioczłonowymi?
pierścienie cykloheksanowe są wolne od naprężenia.
Adolf von Baeyer: Atom węgla „woli” mieć geometrię tetraedryczną z kątami około 109o, pierścienie inne aniżeli pięcio- i sześcioczłonowe mogą być zbyt naprężone, żeby istnieć.
Jakie znasz konformacje cykloheksanu? Która z nich jest najtrwalsza i dlaczego?
Wolna od naprężeń krzesłowa konformacja cykloheksanu. Wszystkie kąty między wiązaniami C-C wynoszą 111,5o (wartość bliska idealnej 109,5o kąta tetraedrycznego) i wszystkie sąsiadujące ze sobą wiazania C-H są naprzemianległe.
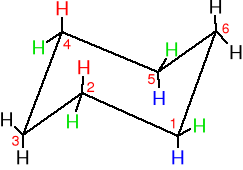
Występujące na przemian aksjalne i ekwatorialne położenia atomów wodoru w konformacji krzesłowej cykloheksanu. Każdy atom węgla ma jeden atom wodoru w położeniu akcjalnym oraz jeden w położeniu ekwatorialnym i każda strona ma na przemian występujące położenia aksjalne i ekwatorialne. Część c) przedstawia obraz cząsteczki cykloheksanu widziany od spodu.
sześć aksjalnych atomów wodoru (równoległych do osi pierścienia)
sześć ekwatorialnych atomów wodoru ma wiązania ułożone płasko w pasie otaczajacym obwód pierścienia.
Konformacja łodziowa cząsteczki cykloheksanu. Obserwuje się w tej konformacji naprężenie steryczne oraz naprężenie torsyjne, natomiast nie obserwuje się naprężenia kątowego.
Narysuj wzór strukturalny cykloheksanu w krzesłowej konformacji z zaznaczeniem wodorów aksjalnych i ekwatorialnych. W jakie położenie aksjalne czy ekwatorialne konformacji krzesłowej cykloheksanu jest korzystniej wprowadzić podstawnik
t-butylowy? Uzasadnij.
Wzajemne przejście aksjalnego i ekwatorialnego metylocykloheksanu. Konformer ekwatorialny jest bardziej trwały od aksjalnego 0 7,6 kJ/mol.
Zaproponuj syntezę alkenów, których wzory są podane. Napisz reakcję, nazwij produkty i substraty.
*Reakcje eliminacji z fluorowcoalkanów
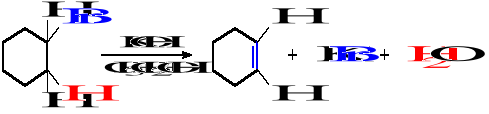
*kraking termiczny
*Reakcje eliminacji z alkoholi
*Reakcja eliminacji
*dehydratacja alkoholi
*depolimeryzacja
Podaj nazwy trzech alkenów, których wzory podano poniżej. Określ, czy jest to izomer E czy Z.
Napisz reakcję addycji niżej podanych związków do wymienionych alkenów:
a)Br2;
kartka
b) HBr;
c) H2O;
H2/Pd
Napisz reakcję hydratacji niżej podanego alkenu z zastosowaniem:
a) BH3 i H2O2, OH-;
b) Hg(OAc)2 i NaBH4
Napisz reakcje niżej podanego alkenu z:
O3;
OsO4 i NaHSO3;
RCO3H i H3O+;
KMnO4.
Podaj przykłady izomerii cis i trans cykloalkanów i alkenów. W jakich przypadkach określenie jej jest niemożliwe?
Brak rotacji wokół wiązania podwójnego węgiel - węgiel jest przyczyną występowania izomerii cis i trans w alkenach.
Izomery cis i trans 2-butenu. Izomer cis ma dwie grupy metylowe po tej samej stronie wiązania podwójnego. W izomerze trans grupy metylowe leżą po przeciwnych stronach tego wiązania
Wymagania konieczne do zaistnienia izomerii cis-trans w alkenach. Związki, w których jeden z atomów węgla jest związany z dwiema identycznymi grupami, NIE mogą istnieć jako izomery cis-trans
Definicja reguły Markownikowa - podaj przykłady.
Podczas przyłączenia HX do alkenu, H przyłącza się do atomu węgla, który ma mniej podstawników, X zaś przyłącza się do atomu węgla, który ma więcej podstawników alkilowych.
ZESZYT Z KORKOW
Omów polimeryzację alkenów na dowolnym przykładzie. Napisz reakcję.
Co to są dieny sprzężone i czym się różnią od innych węglowodorów zawierających wiązania podwójne? Podaj przykłady reakcji.
Jeśli w łańcuchu węglowodorowym występują dwa (dieny) lub więcej wiązań podwójnych, to właściwości związku zależą od położenia tych wiązań względem siebie.
DIEN SKUMULOWANY - wiązania podwójne występują bezpośrednio po sobie
DIEN SPRZĘŻONY - wiązania podwójne są przedzielone jednym wiązaniem pojedynczym
DIEN IZOLOWANY - wiązania podwójne są przedzielone więcej niż jednym wiązaniem pojedynczym
Mają właściwości chemiczne podobne do alkenów, są jednak nieco od nich trwalsze.
Dieny sprzężone są trwalsze od dienów izolowanych.
Jakie znasz metody otrzymywania alkinów? Podaj co najmniej dwie reakcje, nazwij substraty i produkty.
*metoda acetylenowa
* Reakcje eliminacji di halogenków alkanów
* Reakcje eliminacji halogenków winylowych
Czy jest możliwe otrzymanie z alkinu:
a) alkanu, TAK
b) alkenu TAK
Uzasadnij przy pomocy reakcji.
Napisz reakcje niżej podanego alkinu z:
a) BH3, H2O2;
b)H2O,H2SO4,HgSO4;
c) Br2;
HBr.
Napisz reakcje niżej podanego alkinu z:
H2/Pd;
KMnO4;
O3;
d) NH2-.
Co to są acetylenki? Jak powstają i jakim reakcjom ulegają?
grupa związków metaloorganicznych, kompleksy alkilowe alkinów. Na ogół nietrwałe[1]. W związkach tych jeden lub oba atomy wodoru z acetylenu są zastąpione atomami dowolnego metalu. Podwójnie podstawione pochodne acetylenu można także uważać za rodzaj węglików, gdyż zawierają wyłącznie atomy węgla i metalu.
Acetylenki można otrzymać przez działanie alkinów na roztwory soli metali ciężkich (np. srebra i miedzi). Karbid (CaC2) jest wytwarzany w przemyśle dzięki reakcji tlenku wapnia z koksem.
Co to są związki Grignarda? Podaj co najmniej trzy rodzaje reakcji, którym ulegają.
Związki Gringarda są wynikiem reakcji halogenków organicznych z metalicznym magnezem w eterze etylowym lub THF. Związek Gringarda można traktować jako sól magnezową karboanionu. Reagują z kwasami, z powodu charakteru nukleofilowego reagują z całą gamą elektrofili. Reagują z donorami protonów, takimi jak H2O, ROH, RCOOH, RNH2, z wytworzeniem węglowodorów.
Co oznaczają symbole SN1 i SN2 (E1 i E2)? Podaj mechanizmy reakcji oznaczonych tymi symbolami. Jakie czynniki sprzyjają zachodzeniu wyżej wymienionych reakcji?
Sn1 Jest to reakcja pierwszego rzędu; tylko jedna cząsteczka jest zaangażowana w etap reakcji, którego szybkość mierzymy (czyli w najwolniejszy etap reakcji). Stężenie nukleofila nie pojawia się w równaniu na szybkość reakcji.
Sn2
Reakcja przebiega z inwersją konfiguracji na centrum stereogenicznym
Jest to reakcja drugiego rzędu i jej szybkość zależy od stężenia dwóch reagentów:
W stanie przejściowym dla mechanizmu SN2 występuje płaskie ułożenie atomu węgla na którym zachodzi substytucja, oraz pozostałych trzech podstawników
E1 Reakcja E1 podobnie jak SN1 zaczyna się dysocjacją w wyniku której powstaje karbokation.
Jest reakcją konkurencyjną do SN1.
Najlepszymi substratami w reakcji E1 są te same substraty co w reakcji SN1.
Na ogół w wyniku reakcji otrzymujemy mieszaninę produktów eliminacji i substytucji.
Jest to reakcja pierwszego rzędu.
E2
Reakcja ta zachodzi gdy halogenek alkilu jest poddany działaniu mocnej zasady takiej jak jon hydroksylowy (OH־) lub alkoholanowy (RO־).
Jest to reakcja drugiego rzędu, w której zarówno halogenek alkilu jak i zasada uczestniczą w najwolniejszym etapie reakcji i wpływają na szybkość reakcji E2.
Jeśli substytucja nukleofilowa zachodzi na węglu, który jest centrum stereogenicznym, jakiego mechanizmu należy się spodziewać, gdy w rezultacie otrzymamy:
a) mieszaninę racemiczną;
Stereochemia reakcji substytucji nukleofilowej SN1. Czynny optycznie substrat daje w wyniku reakcji produkt, który jest mieszaniną racemiczną
b) inwersję konfiguracji?
Sn2
Uzupełnij niżej podane reakcje halogenoalkilu z nukleofilem.
kartka
W jakich reakcjach fluorowcopochodnych alkilowych stanem przejściowym jest karbokation? Podaj nazwy i mechanizmy reakcji.
Sn1
1.Spontaniczna dysocjacja bromku alkilowego jest powolnym etapem, który określa szybkość reakcji. W procesie tym powstaje produkt pośredni - karbokation, oraz anion bromkowy.
2.Pośredni karbokation reaguje z wodą pełniącą funkcję nukleofila, w szybkim etapie reakcji. Prowadzi to do następnego produktu pośredniego - protonowanego alkoholu.
3.Utrata protonu z pośredniego protonowanego alkoholu prowadzi następnie do obojętnego alkoholu - ostatecznego produktu.
E1
Co to jest reguła Zajcewa? Podaj przykłady.
Wodór odczepia się od tego atomu węgla, który posiada mniej wodorów.
Jakie warunki musi spełniać związek, aby mógł być uznany za aromatyczny? Podaj przykład.
Erich Hückel: Reguła określająca warunki, które musi spełnić cząsteczka aby można ją nazwać aromatyczną.
Jest płaskim układem cyklicznym wiązań skoniugowanych (sprzężonych) z orbitalem p na każdym z atomów tego układu.
Układ zawiera 4n + 2 elektronów na orbitalach p, gdzie n = 1, 2, 3.. tzn. aromatyczne będą cząsteczki zawierające 6, 10, 14, 18… elektronów π.
Napisz reakcje benzenu z:
HNO3, H2SO4;
SO3;
Br2, FeBr3.
Podaj mechanizmy reakcji.
Co powstanie na skutek utlenienia niżej podanych alkilobenzenów? Nazwij produkty i substraty.
Napisz reakcje substytucji elektrofilowej jednego z niżej podanych pochodnych benzenu (nitrobenzen, benzaldehyd, fenol, toluen) za pomocą niżej podanych odczynników. Czy reakcje te będą przebiegać trudniej czy łatwiej w porównaniu z benzenem?
Pod nazwą reakcji Friedla-Craftsa występują dwa rodzaje reakcji podstawienia elektrofilowego. Podaj przykłady.
Zaproponuj sposób otrzymania: a) p-chloronitrobenzenu; b) m-chloronitrobenzenu;
c) butylobenzenu z benzenu. Napisz odpowiednie reakcje.Jak przebiegnie reakcja toluenu z: a) Br2, FeBr3; b) Br2, światło; c) KMnO4? Uzasadnij.
Kiedy atom węgla może być centrum stereogenicznym? Co oznacza pojęcie enancjomery, a co diastereoizomery i jak się różnią ich właściwości?
Enancjomer - stereoizomer, którego cząsteczka nie jest identyczna ze swoim odbiciem lustrzanym
Diastereoizomery - stereoizomery, które nie są enancjomerami
ENANCJOMERY mają takie same właściwości fizykochemiczne np. temperatury wrzenia i topnienia, rozpuszczalność moment dipolowy itd.
Dają takie same widma NMR, poza przypadkami z zastosowaniem rozpuszczalników optycznie czynnych. Nie można ich rozdzielić metodami chromatograficznymi, poza przypadkami zastosowania kolumn z wypełnieniem chiralnym.
DIASTEREOIZOMERY mają różne właściwości fizyko-chemiczne, dają różne widma NMR, można je rozdzielić metodami chromatograficznymi bez konieczności stosowania kolumn chiralnych.
Kryterium ważności podstawników według Cahna-Ingolda-Preloga. Podaj przykłady.
Jak ustalamy konfigurację bezwzględną R lub S? Podaj przykłady.
Kiedy stosujemy pojęcie konfiguracji względnej L lub D i na czym ono polega? Podaj przykłady.
Za podstawę podziału przyjmuje się przestrzenne rozmieszczenie grupy wodorotlenowej i atomu wodoru przy przedostatnim od dołu atomie węgla we wzorze łańcuchowym cukru.
Jako układ odniesienia przyjmuje się odpowiednie rozmieszczenie tych elementów w związku wzorcowym - aldehydzie D lub L glicerynowym
Określ konfigurację R lub S trzech niżej podanych związków.
Zdefiniuj pojęcia:
a) centrum stereogeniczne;
Najczęstszą (chociaż nie jedyną) przyczyną chiralności cząsteczek organicznych jest obecność atomów węgla związanych z czterema różnymi podstawnikami np. centralny atom węgla kwasu mlekowego.
Taki atom węgla nazywany jest centrum asymetrii lub centrum stereogenicznym.
b) mieszanina racemiczna;
Mieszanina racemiczna (racemat) jest to mieszanina równomolowych (1:1) ilości enancjomerów związku chiralnego.
c) forma mezo;
Związki, które są achiralne, ale zawierają centra stereogeniczne nazywamy związkami mezo
skręcalność właściwa.
Światło spolaryzowane w płaszczyźnie przechodzi przez roztwór cząsteczek związku optycznie czynnego, który skręca płaszczyznę polaryzacji. Związki optyczne, które skręcają płaszczyznę polaryzacji w lewo (przeciwnie do ruchu wskazówek zegara) nazywają się lewoskrętnymi (-), natomiast związki, które skręcają płaszczyznę polaryzacji w prawo (zgodnie z ruchem wskazówek zegara) nazywają się prawoskrętnymi (+)
Dlaczego temperatury wrzenia alkoholi i kwasów karboksylowych są wyższe od węglowodorów zawierających tę samą liczbę atomów węgla? Omów na przykładach.
Zaproponuj co najmniej trzy metody otrzymywania alkoholi. Napisz reakcje, nazwij substraty i produkty.
Zaproponuj zastosowanie związków Grignarda do otrzymywania alkoholi: pierwszorzędowych, drugorzędowych i trzeciorzędowych. Podaj przykłady odpowiednich reakcji.
Co otrzymamy w reakcji niżej podanego alkoholu z: a) Na; b) CrO3 lub KMnO4;
c) CH3MgBr; d) CH3COOH w obecności H2SO4?Zaproponuj co najmniej dwie metody otrzymywania fenoli. Napisz reakcje.
Napisz reakcje fenolu z: a) NaOH; b) chlorkiem benzoilu; c) Br2 + FeBr3.
Jak z fenolu można otrzymać: a) ester; b) eter? Podaj reakcje.
Podaj co najmniej trzy przykłady reakcji, którym ulegnie niżej podany fenol .
Co otrzymujemy w reakcji utlenienia: a) alkoholi; b) fenoli; c) aldehydów? Napisz reakcje.
Napisz reakcje: a) fenolan sodu + dwutlenek węgla; b) fenolan sodu + bromek allilu.
Jakie znasz metody otrzymywania eterów? Podaj przykłady reakcji.
Otrzymaj niżej podany eter metodą Williamsona, a następnie poddaj go działaniu HI. Napisz reakcje.
Zaproponuj co najmniej trzy metody otrzymywania aldehydów (ketonów). Napisz odpowiednie reakcje.
Napisz reakcje przyłączenia do niżej podanego aldehydu lub ketonu: a) wody;
b) HCN; c) podanej aminy; d) podanego związku Grignarda.Jak otrzymać z podanego związku karbonylowego: a) hemiacetal i acetal; b) kwas karboksylowy; c) wodzian (hydrat); d) alkohol? Napisz odpowiednie reakcje.
Czy aminy mogą ulegać addycji nukleofilowej do grupy karbonylowej aldehydów lub ketonów. Uzasadnij.
Podaj wzory i nazwy co najmniej dwóch pochodnych aldehydów lub ketonów, które zawierają azot.
Napisz mechanizm kondensacji aldolowej niżej podanych związków.
Jaka reakcja zajdzie, gdy niżej podane związki znajdą się w środowisku zasadowym:
a) C6H5CHO; b) C6H5CHO + CH3-CO-CH3; c) CH3CHO; d) CH3CHO +
CH3-CO-CH3?W jaki sposób można przekształcić niżej podane dwa aldehydy lub ketony w alkany?
Co powstanie w reakcji niżej podanych związków (aldehydów lub ketonów) w wyniku:
a) utleniania za pomocą CrO3; b) redukcji za pomocą NaBH4 lub LiAlH4? Napisz odpowiednie reakcje. Nazwij otrzymane produkty.Na czym polega addycja nukleofilowa do wiązania karbonylowego? Które związki, aldehydy czy ketony, będą łatwiej ulegały tej reakcji i dlaczego?
Podaj co najmniej trzy metody otrzymywania kwasów karboksylowych. Napisz reakcje.
Porównaj właściwości kwasowe alkoholi, fenoli i kwasów karboksylowych.
Napisz reakcje niżej podanych kwasów z: a) SOCl2; b) RMgBr; c) C2H5OH + H2SO4; d) LiAlH4.
Uszereguj pochodne kwasu karboksylowego ze względu na reaktywność chemiczną w reakcji substytucji nukleofilowej do grupy karbonylowej. Uzasadnij.
Jakie znasz sposoby otrzymanie niżej podanego estru? Podaj co najmniej dwa sposoby. Napisz reakcje.
Mechanizm estryfikacji metodą Fishera.
Mechanizm hydrolizy estrów w środowisku kwasowym (zasadowym).
Jakim reakcjom będą ulegać estry kwasów karboksylowych? Podaj co najmniej trzy przykłady.
Napisz reakcje podanego chlorku (bezwodnika kwasowego) z: a) H2O; b) C2H5OH; c) NH3;
d) podaną aminą.W jaki sposób można z podanego kwasu karboksylowego otrzymać: a) ester;
b) chlorek kwasowy; c) alkohol? Napisz reakcje, podaj nazwy substratów i produktów.Napisz reakcje niżej podanego chlorku kwasowego z: a) RMgX; b) C6H6; c) ROH + pirydyna; d) RCOONa.
Podaj co najmniej trzy przykłady reakcji, którym ulegają bezwodniki (chlorki) kwasowe.
Napisz co najmniej dwie reakcje otrzymywania amidów. Nazwij substraty i produkty.
Budowa grupy aminowej i pojęcie zasadowości amin (budowa grupy karboksylowej i właściwości kwasowe kwasów karboksylowych).
Zaproponuj sposób przekształcenia niżej podanego aldehydu (ketonu) w aminę. Napisz odpowiednie reakcje.
Jakie aminy można otrzymać z niżej podanego halogenku alkilu i amoniaku metodą SN2? Napisz odpowiednie reakcje.
Zaproponuj sposób otrzymania niżej podanej aminy przez redukcję co najmniej dwóch różnych pochodnych zawierających azot.
Napisz reakcje niżej podanej aminy z: a) chlorkiem metylu; b) HCl; c) chlorkiem acetylu;
d) bezwodnikiem kwasowym.Zaproponuj sposób otrzymywania aniliny, a następnie przekształcenia jej w
2,4,6-bromoanilinę oraz p-bromoanilinę. Napisz odpowiednie reakcje.W jaki sposób można z heksanoamidu otrzymać: a) heksyloaminę; b) pentyloaminę? Podaj reakcje.
W jaki sposób z aniliny można otrzymać: a) fenol; b) chlorobenzen? Napisz reakcje.
Zaproponuj syntezę dipeptydu.
Z niżej podanej aminy aromatycznej otrzymaj co najmniej trzy związki, wykonując diazowanie, a następnie przekształcenie soli diazoniowych w inne pochodne. Nazwij substrat i produkty.
Napisz reakcje niżej podanej pierwszorzędowej aminy alifatycznej z CH3J, a następnie z Ag2O, H2O. Jaki będzie główny produkt reakcji? Nazwij substraty i produkty.
Podaj trzy metody otrzymywania aminokwasów.
Podaj przykłady: a) aminy pierwszorzędowej; b) aminy drugorzędowej; c) aminy trzeciorzędowej; d) soli amoniowej. Napisz wzory i podaj nazwy związków.
Jak określamy konfigurację D i L w przypadku węglowodanów?
D-cukry. Grupa hydroksylowa na centrum stereogenicznym najdalszym od grupy karbonylowej znajduje się po prawej stronie, gdy cząsteczkę przedstawi się w projekcji Fischera
Podaj wzór łańcuchowy, Hawortha i krzesełkowy dowolnej heksozy. Określ jaki to anomer i jaka to konfiguracja względna. Uzasadnij.
Co to jest mutarotacja? Omów na przykładzie.
Podaj reakcje przekształcania aldoheksozy (na dowolnym przykładzie) w: a) kwas aldonowy; b) kwas aldarowy; c) osazon.
Na czym polegają właściwości redukujące cukrów?
Egzamin zerowy - pytania: 60-100
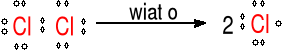
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Pytania treningowe, Studja, Chemia Organiczna
stres pytania i część odp
pytaniareszta, studia, wnożcik, chemia organiczna, egzamin
Chemia organiczna czesc I poprawiona
Chemia organiczna pytania na egzamin
Chemia organiczna i fizyka pytania egzaminacyjne
Chemia organiczna część 1
Chemia organiczna - pytania na koła, towaroznawstwo
Mastalerz P ''Chemia Organiczna'' część I
Kol 3AApop, I rok, I rok, Chemia ogólna, giełdy, Chemia, CHEMIA ORGANICZNA, CHEMIA ORGANICZNA
pytania organiczna 2. rok, rok numero deux, chemia organiczna, koła ze skryptu
Kol Zal 01A, I rok, I rok, gieldy, pen, medycyna, 2 semestr, Chemia, z jagiellonskiego, Chemia, CHEM
pytania gr A, biologia 1 rok, CHEMIA, Chemia organiczna
Kol Zal 03A (nowy), I rok, I rok, gieldy, pen, medycyna, 2 semestr, Chemia, z jagiellonskiego, Chemi
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
Jako 2A, I rok, I rok, gieldy, od Karoliny, medycyna, 2 semestr, Chemia, z jagiellonskiego, Chemia,
więcej podobnych podstron