PODSTAWOWE TECHNIKI BADAŃ MIKROBIOLOGICZNYCH.
PODŁOŻA BAKTERYJNE I METODY HODOWLI DROBNOUSTROJÓW.
PRZYGOTOWANIE PODŁOŻY.
INOKULACJA HODOWLI BAKTERII NA RÓŻNYCH PODŁOŻACH.
Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym, studenci zobowiązani są używać fartuchów i rękawiczek jednorazowych.
W mikrobiologii z powodu bardzo małych rozmiarów mikroorganizmów bada się najczęściej ich populacje, a nie poszczególne osobniki. Koniecznym elementem techniki mikrobiologicznej jest więc izolowanie i hodowanie mikroorganizmów w czystej kulturze tzn. kulturze stanowiącej potomstwo jednego, pierwotnie wyodrębnionego drobnoustroju. Wszystkie zabiegi związane z otrzymywaniem czystych kultur muszą być przeprowadzane w warunkach zupełnej jałowości (sterylności). Jałowe jest takie środowisko, które nie zawiera żadnych organizmów żywych ani przetrwalników.
Izolacja czystych kultur wymaga oprócz opanowania techniki sterylizacji również znajomości sporządzania i wykorzystywania odpowiednich pożywek.
Podłoża mikrobiologiczne
Podłoże mikrobiologiczne to sztucznie stworzone środowisko wzrostu do hodowli drobnoustrojów. Jest to zazwyczaj mieszanina odpowiednio dobranych składników odżywczych, służąca do hodowania drobnoustrojów w warunkach laboratoryjnych. Podłoża stosowane są do izolacji, różnicowania, identyfikacji i namnażania drobnoustrojów, określania ich właściwości fizjologicznych, biochemicznych i hodowlanych, jak również do otrzymywania określonych produktów metabolizmu bakterii.
Pożywki do hodowli bakterii powinny charakteryzować się nastepującymi cechami:
muszą zawierać przyswajalne źródła pierwiastków biogennych (C, O, H, N, P, S), energii, soli mineralnych (Na, Ca, K, Mg), mikroelementów (Mn, Zn, Mo, Cu, Co, Ni), substancji wzrostowych (aminokwasy, witaminy);
powinny wykazywać optymalny dla wzrostu danego rodzaju drobnoustrojów odczyn pH oraz potencjał redoks;
powinny wykazywać odpowiednią wartość ciśnienia osmotycznego;
muszą być przejrzyste (wyjątek: podłoża zawierające związki nierozpuszczalne, np. CaCO3, tłuszcze);
muszą być jałowe;
Dodatkowo podłoża bakteriologiczne mogą zawierać:
substancje różnicujące
składniki wybiórcze
czynniki zestalające
PODZIAŁ PODŁOŻY MIKROBIOLOGICZNYCH
ZE WZGLĘDU NA SKŁAD CHEMICZNY
naturalne - podłoże o nie w pełni zdefiniowanym składzie chemicznym zawierające wyciągi z tkanek roślinnych lub zwierzęcych, hydrolizaty białkowe, itp.; M.in. bulion odżywczy, brzeczka, mleko odtłuszczone lub pełne;
syntetyczne - złożone ze związków chemicznych o ściśle określonym
i znanym składzie chemicznym (jakościowym i ilościowym);
półsyntetyczne - są częściowo poznane pod względem składu substancji odżywczych, np. podłoże M9 wg Adamsa wzbogacone dodatkiem glukozy
i autolizatu drożdży (do hodowli drobnoustrojów Proteus i Escherichia);
ZE WZGLĘDU NA ZAWARTOŚĆ SKŁADNIKÓW ODŻYWCZYCH
pełne - zawierają wszystkie niezbędne substancje odżywcze, umożliwiające dobry wzrost drobnoustrojów (np. bulion odżywczy);
minimalne - zawierają tylko składniki pokarmowe, które są niezbędne do podtrzymania wzrostu drobnoustrojów (np. podłoże M9 wg Adamsa);
wzbogacone - sporządza się dla drobnoustrojów słabo rosnących in vitro wymagających w tych warunkach dodatkowych substancji odżywczych; jako czynniki wzbogacające stosowane są: krew, surowica, płyny wysiękowe, wyciąg wątrobowy, mleko;
ZE WZGLĘDU NA KONSYSTENCJĘ
płynne - służą głównie do namnażania drobnoustrojów
półpłynne - zawierają 0,1-0,7% agar i służą do hodowli mikroorganizmów o mniejszym zapotrzebowaniu na tlen; na podłożach tych bada się również ruch bakterii;
stałe - zawierają 1,5-2% agar i służą obok namnażania baketrii do ich różnicowania;
ZE WZGLĘDU NA PRZEZNACZENIE I ZASTOSOWANIE
namnażające - służą do otrzymywania dużej biomasy drobnoustrojów badanego szczepu; najczęściej są to podłoża płynne;
wybiórcze - podłoża zawierające dodatek związków chemicznych hamujących wzrost konkretnej grupy drobnoustrojów;
namnażająco-wybiórcze - pozwalają na namnożenie się tylko jednemu rodzajowi lub gatunkowi drobnoustrojów lub jednej grupie mikroorganizmów, znajdujących się w posiewanym materiale; podłoża te zawierają składniki hamujące wzrost jednych i ułatwiające namnażanie drugich drobnoustrojów;
izolacyjne - podłoża stałe (płytki), zawierające odpowiedni wskaźnik (identyfikator) pozwalający odróżnić od siebie kolonie bakterii;
różnicujące - są to podłoża identyfikujące i diagnostyczne; pozwalają na rozróżnienie dwóch typów bakterii;
Przygotowując podłoża należy:
- używać szkła odpowiednio umytego i wypłukanego;
- przestrzegać ściśle przepisów przygotowywania pożywek (odważać dokładnie składniki, uważać na kolejność ich dodawania i na uwodnienie soli);
- używać tylko wody destylowanej;
- ustalić odpowiednie pH podłoża;
- do jałowienia rozlać je do kolb o odpowiednich objętościach (nigdy nie więcej niż ¾ objetości naczynia) gdyż mogą kipieć;
- kolby zakorkować korkami lub nałożyć kapturki z folii aluminiowej;
- zautoklawować;
Hodowla (kultura) drobnoustrojów to zespół osobników żyjących w tym samym środowisku. W laboratorium hodowlę drobnoustrojów stanowią osobniki wyrosłe na jednym podłożu. Wyróżniamy 2 rodzaje hodowli: czyste i mieszane.
Hodowla czysta to zbiór osobników tego samego gatunku stanowiący potomstwo pierwotnie wyodrębnionej interesującej nas bakterii rosnących na podłożu.
Hodowla mieszana to hodowla w skład której wchodzą osobniki różnych gatunków. Z hodowlami mieszanymi mamy do czynienia we wstępnych etapach klinicznej diagnostyki laboratoryjnej i w środowisku naturalnym.
TECHNIKA POSIEWÓW
W środowisku naturalnym bakterie zwykle rosną w postaci złożonych zespołów drobnoustrojów. W laboratorium zwykle pracuje się z czystymi kulturami jakiegoś konkretnego szczepu bakterii. Posiew mikrobiologiczny jest to przeniesienie badanego materiału na jałową pożywkę. Wszystkie posiewy wykonuje się przestrzegając zasad sterylności, czyli posiew wykonuje się przy zapalonym palniku, opalając wyloty naczyń i pipet w płomieniu palnika, a także wyżarzając używane podczas posiewu ezy i igły.
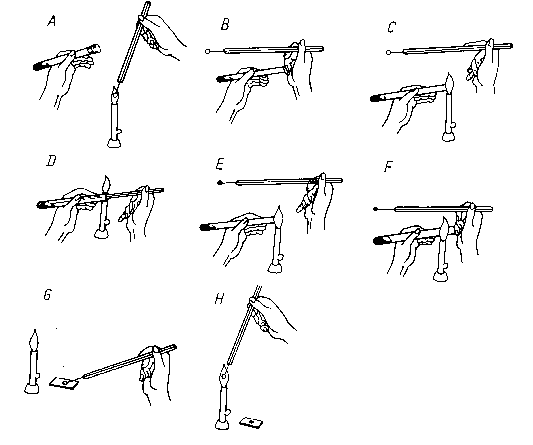
Rys.1. Pobieranie hodowli do badań ze skosu agarowego A - jałowienie ezy w płomieniu, B - otworzenie probówki, - opalanie brzegu probówki, D - pobieranie materiału, E - opalanie brzegu probówki, F - zamykanie probówki przy palniku, G - przenoszenie materiału na szkiełko, H - jałowienie ezy w płomieniu.
Należy pamiętać, że każdorazowo przed rozsianiem materiału opalamy ezę w płomieniu palnika!
Materiał mikrobiologiczny nanosimy tylko raz, później jedynie go rozprowadzamy jałową ezą po całej powierzchni płytki.
WYKONYWANIE POSIEWÓW EZĄ
Ezę używamy do posiewów na podłożach płynnych lub na podłożach stałych w skosach agarowych w probówkach albo też w płytkach Petriego.
Rys.2. Posiew za pomocą ezy na płytce Petriego - 1, 2, 3, 4 kolejność przenoszenia materiału
SPOSOBY WYKONYWANIA POSIEWÓW:
na podłożu płynnym należy pobrać ezą badany materiał, a następnie zanurzyć
w probówce z pożywką i lekko potrząsając ezą wypłukać materiał z jej oczkana skosie agarowym pobieramy ezą badany materiał, a następnie dotykamy ezą powierzchni skosu i ruchem falistym lub zygzakowatym przeciągamy ezę po powierzchni podłoża w kierunku wylotu probówki
na płytce Petriego odrobinę badanego materiału rozprowadza się zygzakiem lub promieniście na całej powierzchni zestalonego podłoża agarowego lub też dzieli się je na sektory i w nich rozprowadza materiał.
POSIEW ILOŚCIOWY
Posiew ilościowy stosuje się w przypadku konieczności oznaczenia liczby drobnoustrojów w badanym materiale. Liczbę żywych komórek w hodowli pierwotnej można określić na podstawie kolonii wyrastających na podłożu. Ponieważ liczba komórek bakterii
w hodowli pierwotnej może sięgać 1010, a dogodna liczba dających się policzyć kolonii na płytce zawiera się między 30 i 200, zazwyczaj hodowlę rozcieńcza się stosując serię dziesięciokrotnych rozcieńczeń (1 ml hodowli + 10 ml płynu), co daje policzalną liczbę komórek w 0,1 ml. Ponieważ dokładna liczba kolonii w hodowli pierwotnej nie jest znana, zwykle na szalki wylewa się po 0,1 ml różnych rozcieńczeń, tak, aby jedno z nich dawało liczbę komórek na płytce.
Po sporządzeniu odpowiedniego rozcieńczenia wykonujemy posiew ilościowy metodą płytkową. Po okresie inkubacji do pomiarów bierze się te płytki, na których liczba kolonii mieści się
w granicach od 30 do 200.
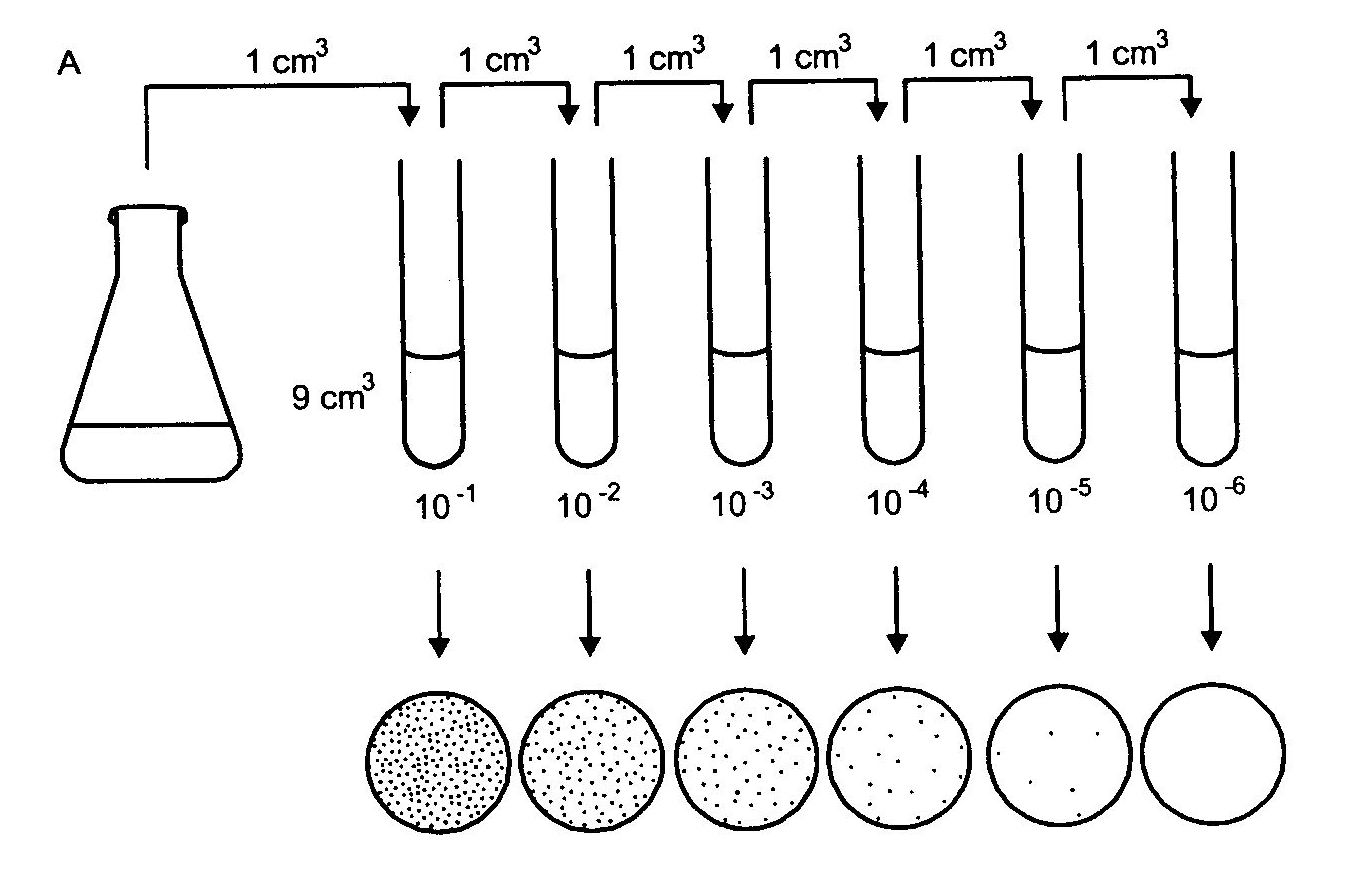
Rys.3. Schemat ilustrujący metodę seryjnych rozcieńczeń w celu określenia liczby żywych bakterii w hodowli.
IZOLACJA CZYSTYCH KULTUR
W badaniach mikrobiologicznych posługujemy się czystymi kulturami bakterii. Czystą kulturę definiuje się jako potomstwo pojedynczej komórki (klon). Izolacje czystej kultury badanego mikroorganizmu przeprowadza się zazwyczaj na podłożach stałych. Najpierw pojedyncza komórka musi zostać odseparowana od reszty populacji. Następnie przez ostrożne pobranie wyrosłej kolonii, zawieszenie jej w odpowiednim roztworze i wielokrotne wysianie metodą redukcyjną na podłożu agarozowym można otrzymać czystą kulturę badanego szczepów.
Sposoby izolacji czystych kultur wykonujemy przez zastosowanie:
posiewu na całej powierzchni (A),
posiewu sektorowo - redukcyjnego (B). Płytkę Petriego z zestalonym podłożem dzielimy na cztery sektory. Pobrany do izolacji materiał rozsiewamy ezą przez wszystkie sektory,
metody płytek lanych (C) polega na posiewie odpowiedniego rozcieńczenia
(10-4; 10-5) zawiesiny bakterii i wykonaniu posiewu techniką wgłębną.
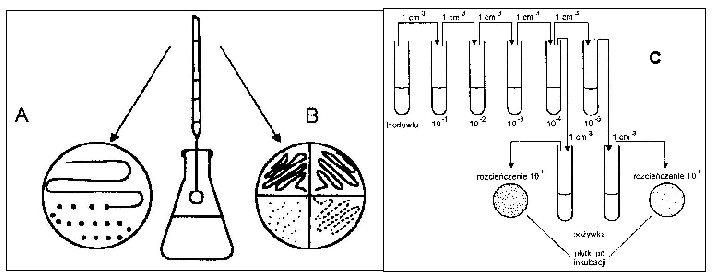
Rys.4. Izolacja czystych kultur metodą posiewu na całej powierzchni (A), sektorową (B) oraz płytek lanych (C).
CZĘŚĆ PRAKTYCZNA
Przygotowanie pożywki płynnej dla E. coli
Odważyć składaniki:5 g NaCl
10 g pepton
5 g wyciąg drożdżowy
rozpuścić w 1000 ml wody destylowanej.
Sprawdzić pH 7.4 przy pomocy papierka wskaźnikowego.
Rozlać pożywkę rozlać do 2 kolbek po 50 ml.
Kolbki zatkać korkami z waty i folią aluminiową.
Kolbki jałowic w autoklawie przy nadciśnieniu 1 atm. przez 30 minut.
Resztę pożywki zużyć do zrobienia agaru odżywczego.
Rozlewanie bulionu odżywczego do probówek
Przestrzegając zasad pracy sterylnej rozlać jałowo do 3 probówek po 3 ml sterylnego bulionu.
Jedną probówkę pozostawić w temperaturze pokojowej,
Drugą inkubować przez noc w 37ºC.
Trzecią zaszczepić hodowlą E.coli.
Po tygodniu sprawdzić jałowość pożywki w dwóch probówkach
Rozlewanie bulionu odżywczego do probówek:
Przygotować w statywie sterylne probówek z korkami o pojemności 15 ml;
Odkorkować kolbkę z podłożem i opalić jej wylot w płomieniu palnika;
Rozlewać bulion po 3 ml
Opalić wylot probówki i zamknąć ją;
Opalić wylot kolby i zamknąć korkiem;
Przygotowanie agaru odżywczego (pożywka stała) i skosu agarowego.
Do kolby o pojemności 250 ml odważyć 1.5 g sproszkowanego agaru i wlać 100 ml pożywki LB.
Kolbę zamknąć folią aluminiową. Zautoklawować przy nadciśnieniu 1 atm. przez 30 minut.
Po ostygnięciu (ok. 50-60°C) rozlać agar odżywczy na płytki.
Rozlewanie pożywki stałej na płytki Petriego:
Odkorkować kolbkę z pożywką i opalić jej wylot w płomieniu palnika;
Uchylić lekko wieczko szalki Petriego i wlać do niej pożywkę tak, aby utworzyła na dnie kilkumilimetrową warstwę (około 10-12ml podłoża);
Zamknąć płytkę;
Ponownie opalić w płomieniu wylot kolby z podłożem i zamknąć ją korkiem;
Płytkę pozostawić na stole do czasu zestalenia podłoża;
Po zabezpieczeniu schować płytkę z podłożem do lodówki;
Techniki posiewów na przykładzie bakterii E.coli
Posiew ezą na podłożu płynnym
Posiać ezą inokulum pobrane z hodowli płynnej do jednej probówki z 3ml bulionu
Posiew ezą na płytkę z agarem odżywczym
Na skos z agarem odżywczym - wężykiem
Na płytkę z agarem odżywczym - posiew redukcyjny wg schematu
2 1 - początek linii posiewu
2,3 - miejsca, w których przerywa
się posiew i opala ezę w celu
usunięcia nadmiaru materiału
1 3
3
Posiew pipetą metodą powierzchniową
Na płytkę z podłożem agarowym nanieść 1 ml (sterylnie) wcześniej przygotowanej hodowli bakteryjnej;
Sterylną głaszczką rozprowadzić hodowlę po całej powierzchni szalki
Wyszukiwarka
Podobne podstrony:
INSTRUKCJA POBIERANIA PROBEK SWUR, weterynaria, Analityka, Próbówki
ch1-pobieranie probek, weterynaria, Analityka, Próbówki
an zaoczneV pprobek, weterynaria, Analityka, Próbówki
analityka 1, weterynaria, Analityka
Analityka w laboratorium, weterynaria, Analityka, Próbówki
ANALITYKA KLINICZNA, Weterynaria Lublin, Weterynaria 1, Diagnostyka
Tabele kliniczne weterynaria, analityka kliniczna chorób psów i kotów
aimzs, weterynaria, Analityka, Próbówki
INSTRUKCJA POBIERANIA PROBEK SWUR, weterynaria, Analityka, Próbówki
ch1-pobieranie probek, weterynaria, Analityka, Próbówki
Aminy analityka
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
FENOLE analityka
Węglowodory analityka
AT kurs analityka giełdowego 3
Cw 8 Analityka
poprawki analityczna
więcej podobnych podstron