0000073 (4)

Kryształy o wiązaniach jonowych. Jony działają między sobą siłami elektrycznymi podlegającymi prawu Coulomba. Pole elektryczne wytwarzane przez jon rozciąga się sferycznie na wszystkie strony. Pole to działa na wszystkie jony znajdujące się w jego zasięgu. Sity elektryczne nie ograniczają się do jednej pary jonów (anionu i kationu), każdy jon działa na wszystkie pozostałe, przyciąga jony znaku przeciwnego, odpycha ze znakiem zgodnym. Wiązania jonowe nie ulegają więc nasyceniu. Każdy jon otacza się możliwie ciasno jonami znaku przeciwnego, w ten sposób tworzą się struktury, w których jony występują na przemian ze znakami przeciwnymi, struktury o najmniejszej w danych warunkach energii swobodnej. Przykładami mogą być sieci NaCl i CsCI, obie są sieciami regularnymi, chociaż nie prostymi (ryc. 3.7 i ryc. 3.8).

Ryc. 3.7. Model sieci krystalicznej NaCl. Jony Na1' — kółka puste, Cl- — pełne.

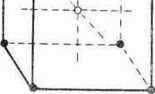
Ryc. 3.8. Model sieci krystalicznej CsCI. Jony Cs+ — kółka puste, Cl- — pełne.
Struktury sieci jonowej mogą być bardziej złożone, jeżeli występują w nich jony złożone, względnie jeszcze dodatkowo woda krystalizacyjna.
W kryształach jonowych cząsteczki tracą swoją indywidualność, cały kryształ tworzy jedną wielką makrocząsteczkę (NaCl),,, czy (CsCI)„. Wiązania jonowe należą do silnych. Energia wiązania wynosi rzędu kilku eV/atom. Kryształy o takich wiązaniach mają wysoką temperaturę topnienia (NaCl — 804°C, CaO — 2572°C). Są na ogół kruche, lupliwe; przemieszczenie jednej warstwy jonów względem drugiej o jeden węzeł powoduje bowiem odpychanie się tych warstw (ryc. 3.9).

Ryc. 3.9. Przemieszczenie jednej warstwy jonów względem drugiej o jeden węzeł powoduje odpychanie się tych warstw.
Kryształy jonowe są na ogół przeźroczyste, źle przewodzą prąd elektryczny oraz ciepło. Elektrony są zaangażowane w wiązaniach i nie mogą współdziałać ze światłem czy przemieszczać się w polu elektrycznym. Kryształy jonowe rozpuszczające się w wodzie ulegają dysocjacji.
Kryształy o wiązaniach kowalencyjnych. W przeciwieństwie do oddziaływań elektrycznych wiązania kowalencyjne ograniczają się wyłącznic do najbliższych sąsiadów, z którymi wiążące się atomy mają wspólne elektrony. Wypadkowy ładunek elektryczny każdego atomu jest zerem. Sieć przestrzenną o wiązaniach kowalencyjnych mogą tworzyć atomy mające co najmniej cztery elektrony walencyjne, a więc począwszy od C, Si, Ge. W przy-
80
Wyszukiwarka
Podobne podstrony:
egzamin chem3 wiązania zdelokalizowane - są to takie wiązania, które na skutek oddziaływać między so
296 (22) 5.1,7. Wiązania o charakterze pośrednim Wiązaniem o charakterze pośrednim między wiązaniem
120 2 Kryształy o wiązaniach międzycząstcczkowych (molekularne) W węzłach sieci krystalicznej kryszt
Zdjęcie1072 alfa-hydroksykwasy . ; rozluźnienie wiązań Jonowych I wodorowych między komeocytaml ■»
Model kryształów jonowych 1. Jony w strukturach kryształu są
Model kryształów jonowych 1. Jony w strukturach kryształu są
*; ne v. wodzie jony węglanowe, wodorowęglanowe oraz wolny ditlenek węgla są z. . z r; między sobą r
Image526 Układy translatorów sygnałów MOS/TTL Wyjścia układów MOS różnią się między sobą w zależnośc
Zdj 25252525EAcie530 PODSTAWOWE SZKOŁY PSYCHOTERAPEUTYCZNE RÓŻNIĄ SIĘ MIEDZY SOBĄ CELAMI PSYCHO
Zdjęcie0944 Podczas pobytu w szkole, uczniowie ćwiczą się między sobą w stosowaniu praktycznym gimna
img259 gą zachowywać się o wiele swobodniej. Mogą rozmawiać między sobą, zmieniać pozycję, wstać od
PA050104 ■ HansTomaeza rozwój uważają: ■ ciąg zmian pozostających miedzy sobą w we wzajemnym związku
więcej podobnych podstron