1

KINETYKA REAKCJI ENZYMATYCZNYCH Wyznaczanie stałej Michaelisa (KM) na przykładzie kwaśnej fosfatazy (EC 3.1.3.2)
WSTĘP
Kinetyka enzymatyczna stanowi dział enzymologii zajmujący się badaniem szybkości reakcji enzymatycznych (gr. kinezis - ruch) oraz wpływu na nią różnych czynników. Podstawą kinetyki enzymatycznej jest analiza aktywności enzymu, której miarę stanowi szybkość katalizowanej przez enzym reakcji. Wyraża się ją przyrostem ilości produktów lub spadkiem stężenia substratu w jednostce czasu. Na przebieg reakcji enzymatycznej wpływa wiele czynników chemicznych i fizycznych, takich jak budowa i stężenie enzymu, stężenie substratu, temperatura, pH, stężenie aktywatorów i inhibitorów.
W celu poznania ogólnego mechanizmu działania enzymu, szczególnie istotne jest badanie wpływu stężenia substratu na szybkość reakcji enzymatycznej.
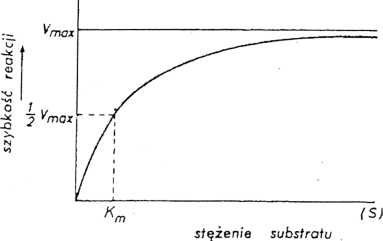
Rys. 1. Zależność szybkości reakcji enzymatycznej od stężenia substratu (przy stałym stężeniu enzymu).
Dla wielu enzymów zależność szybkości reakcji (v) od stężenia substratu (S) może być wyrażona prostą zależnością matematyczną, której obrazem graficznym jest hiperbola (Rys. 1).
Dane kinetyczne przedstawione na powyższym rysunku opisuje równanie MichaelisaMenten Vmax [S]
v = -
Km + [S]
1
Wyszukiwarka
Podobne podstrony:
7] PARAMETRY KINETYCZNE REAKCJI 125 t Ryc. 3. Wyznaczanie stałej Michaelisa (Km) i szybkości
CCF20081011�008 (3) Wyznaczanie stałej Michaelisa Km dla reakcji hydrolizy sacharozy przez inwertazę
CCF20081011�008 Wyznaczanie stałej Michaelisa Km dla reakcji hydrolizy sacharozy przez inwertazę z d
skanowanie0011 Kinetyka reakcji enzymatycznych Wyprowadzenie równania Michaelisa-Menten. Stała Micha
WYKŁAD 2 enzymy cz 1 (30) KINETYKA REAKCJI ENZYMATYCZNEJ 0 Wpływ stężenia substratu na szybkość r
enzymy2 V max I S ] V =------------ Km+rSJ Równanie to pozwafa obliczyć parametry kinetyczne reakcji
szybkości reakcji chemicznej. 18. Kinetyka reakcji enzymatycznych. Równanie
Ćwiczenie 5aBadanie kinetyki reakcji enzymatycznych przy użyciu programu komputerowego Gepasi Gepasi
1 4skanowanie0001 KINETYKA REAKCJI ENZYMATYCZNYCH Odczynniki: * flfpll bufor octan
1 Kinetyka reakcji enzymatycznej 2 Mechanizm działania enzymów V
więcej podobnych podstron