238 2
Kinetykę reakcji opisuje równanie
k'c^c
A
dcA
dr
( \2 O
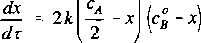
gdzie x jest zmianą stężenia tlenu, a k = 2k!. Całkując ostatnie równanie otrzymuje się
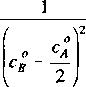
kt
Następnie po przekształceniach i podstawieniu danych liczbowych uzyskuje się równanie umożliwiające numeryczne wyznaczenie wartości x
= 0
Wartość ta wynosi 5,4927 i stąd określa się skład mieszaniny: 2,3% NO; 36,2% 02 i 61,5% N02.
Przykład 7.3.3
Określić, w jakiej temperaturze pewna reakcja osiągnie wybrany stan w ciągu 15 minut, jeżeli w temperaturze 300 K osiąga go w czasie 1 godziny. Współczynnik temperaturowy reakcji a = 3.
Rozwiązanie
Zgodnie z regułą Hessa zmiana stałej szybkości reakcji w funkcji temperatury wynosi
T2~T1 io ~
a
skąd wynika, że
3°^
ln ar kx
Ponieważ czas przebiegu reakcji r jest odwrotnie proporcjonalny do stałej szybkości reakcji, więc
*2 = Jl
kl T2
238
Wyszukiwarka
Podobne podstrony:
szybkości reakcji chemicznej. 18. Kinetyka reakcji enzymatycznych. Równanie
P3230280 Dla funkcji sklejanej umocowanej mamy liniowy układ równań Ap = ć, (31) g
Scan147 170 34.22. Równanie Stokesa / - 6iu , gdzie T
skanowanie0011 Kinetyka reakcji enzymatycznych Wyprowadzenie równania Michaelisa-Menten. Stała Micha
b) Reakcja II rzędu: równanie kinetyki reakcji = kc skąd k = dc c c°c Dla c 1
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
PB250276 I Szybkość reakcji v definiuje równanie: v=± 1 dCjl Vj dt
Zdjęcie0160 Reakcje większości enzymów opisuje równanie Michaellsa-Menten: szybkość maksymalna szybk
więcej podobnych podstron