5

Siateczka ziarnista (szorstka)
Związek rybosomów z siateczką
Związek rybosomów z błoną nie jest zjawiskiem stałym. Dryfujące swobodnie w cytoplazmie, rybosomy przyłączają się bowiem do siateczki tylko wtedy, gdy aktualnie syntetyzująbiałka, które winny zostać odseparowane błoną od składmKow cytopłazmy (bSETwytESeEicze ienzymy lizosomowe), bądź też zostać wbudowane w samą błonę.
Po przemieszczeniu się peptydów przez błonę lub po ich wbudowaniu w błonę, rybosomy wchodzące w skład polisomu kolejno odpadają od błony siateczki. Siateczka śródplazmatyczna ziarnista pozbawiona rybosomów nie staje sięjednak siateczką gładką, gdyż zachowuje odmienny układ przestrzenny.
Ponowne przyłączenie się dużych podjednostek rybosomów do siateczki następuje w tych samych co poprzednio miejscach, choć nie dotyczy tych samych rybosomów. Ponieważ tempo syntezy białek na eksport znacznie przewyższa tempo syntezy białek przeznaczonych na potrzeby własne komórki, rybosomy związane z siateczką w praktyce odzwierciedlają proces produkcji wydzieliny.
Proces translacji białek wydziełniczych rozpoczyna się od syntezy sekwencji aminokwasów zwanej peptydem sygnałowym, wiodącym lub transportującym (ang. signal peptide, leader peptidelub transport peptide). Obecnie najczęściej stosowany jest termin pierwszy, chociaż nazwa „peptyd wiodący” lepiej oddaje biologiczne znaczenie tego peptydu, zwłaszcza że istnieją również inne sekwencje aminokwasowe pełniące rolę sygnałów skierowujących peptydy do poszczególnych przedziałów komórki.
Peptyd sygnałowy
W większości produktów wydziełniczych komórek eukariotycznych peptyd ten stanowi początkowy, zwrócony do końca NH2 fragment łańcucha o długości 15-29 aminokwasów Niekiedy (np. w owoalbuminie) fragment peptydu o własnościach poptydu sygnałowego zlokalizowany jest w środku cząsteczki.
Dokładne badanie sekwencji aminokwasowej peptydów sygnałowych w różnych komórkach wykazało brak zasadniczej homologii pomiędzy nimi. Co więcej, zdarza się, że w tej saffięj komórce różne białka wydziełnicze transportowane są do wnętrza siateczki przy udziale niejednakowych peptydów sygnałowych (tak jest np. w przypadku kazeiny, a-laktoalbuminy i (f-lakto-globuliny w komórkach gruczołu mlekowego). Niewykiuczona jest, że zróżnicowanie odcinków sygnałowych umożliwia skierowanie różnych białek do odmiennych obszarów siateczki. Tym niemniej zidentyfikowane peptydy sygnałowe wykazują pewne cechy wspólne (rys. 13.2) i wyróżnić w nich można trzy główne obszary (domeny):
1) obszar spolaryzowany zaczynający się grupą NH2 i zawierający jedną lub więcej reszt obdarzonych ładunkiem;
2) hydrofobowy obszar środkowy, zbudowany z 9-i 8 aminokwasów pozbawionych grup polarnych, wśród których szczególnie często występują aminokwasy z długimi łańcuchami' bocznymi (leucyna, izoleucyna, fenyloałanina i walina);
3) końcowy fragment peptydu sygnałowego, który zawiera informację powodującą odcięcie całego peptydu przez peptydazę sygnałową (patrz dalej). Odcięcie to z reguły następuje po niepolar-nych aminokwasach o krótkich łańcuchach (alanina lub glicyna, a rzadziej po serynie lub cysteinie).
Podczas translacji białka wydzielniczego peptyd sygnałowy ukryty jest początkowo w kanale dużej podjednostki rybosomu. Gdy długość syntetyzowanego łańcucha peptydowego przekroczy 30-40 aminokwasów, koniec NH2 i następujące po nim aminokwasy zaczynają się wysuwać do cytopłazmy, co umożliwia przyłączenie się cząsteczki rozpoznającej sygnał (signal recognizing particie — SRP).
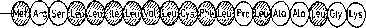
a!
nh2
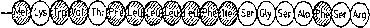
Rys. 13.2. Przykłady odcinków sygnałowych: a — dla hormonu wzrostu (u szczura), b — dla albuminy. Zakreskowanym kółkiem oznaczono aminokwasy hydrofobowe
b) nh2
Cząsteczka rozpoznająca sygnał (SRP)
Zadaniem cząsteczki rozpoznającej sygnał (SRP) jest skierowanie syntetyzowanego peptydu do miejsca współtranslacyjnej translokacji przez błonę siateczki śródplazmatycznej (p.dalej), co dokonuje się poprzez reakcję SRP z odpowiednim receptorem w błonie tejże siateczki (SRP-receptor).
SRP jest rybonukleoproteiną zlokalizowaną w cytoplazmie, w skład której wchodzi 7SRNA oraz 6 peptydów o masach: 9,14,19,54,68 i 72 kD. W rozpoznaniu odcinka sygnałowego bierze udział peptyd 54 kD bogaty w reszty metioninowe, które tworzą hydrofobową „kieszonkę” dla spodkowego fragmentu odcinka sygnałowego. W tym samym peptydzie znajduje się obszar, który przyłącza GTP w momencie, gdy SRP połączy się z odcinkiem sygnałowym. Również wtedy podjednostki 9 kD i 14 kD docierają do miejsca akceptorowego rybosomu (patrz rozdz. 12) i blokują przyłączanie napływającego tRNA. Pozostałe podjednostki 68 kD i 72 kD mają uczestniczyć w skierowaniu SRP do siateczki śródplazmatycznej.
Miejsce translokacji i transport przez błonę białek wydziełniczych
Miejsce translokacji (przemieszczenia peptydu poprzez błonę siateczki) zwane translokonem stanowi skupisko integralnych białek siateczki, które tworzą hydrofilny kanał umożliwiający przemieszczenie się peptydu przez błonę. Przy użyciu światłowrażliwych sond wbudowanych do transportowanego peptydu udało się zidentyfikować w transłokonie ssaków trzy podstawowe elementy: receptor dla SRP, białko Sec 6! oraz białko TRAM (translocating chain associated membranę protein). Z translokonem związane są ponadto białka błonowe uczestniczące w pierwszych etapach potranslacyjnych przemian powstającego peptydu: peptydaza sygnałowa, zespół transferazy oligosacharydowej oraz kalneksyna. Translokon nie stanowi struktury trwałej, jego powstanie zainicjowane jest prawdopodobnie reakcją SRP z jej receptorem, a pozostałe składniki grupują się w błonie doraźnie w miarę przesuwania się peptydu.
SRP-receptor zwany inaczej białkiem dokującym, umożliwia przejściowe związanie syntetyzowanego peptydu, za pośrednictwem SRP, z cytoplazmatyczną powierzchnią błony siateczki, co oznacza równocześnie przyciągnięcie do niej rybosomu. SRP (m. 72 000) składa się z dwóch podjednostek: ot i p, z których każda ma zdolność przyłączania GTP. Reakcja SRP z receptorem Obejmuje kilka etapów: przyłączenie SRP do podjednostki a, wymianę GDP związanego z tą podjednostką na GTP, oddzielenie SRP od odcinka sygnałowego i od rybosomu i wreszcie hydrolizę
229
Wyszukiwarka
Podobne podstrony:
prawdziwość wniosków. Związek łączący zdania nie jest już tak mocny logicznie, ale posiada inne zale
phoca thumb l slajd22 (17) Związek rybosomów z siateczką ■ nie jest zjawiskiem sta
DNA - geny kolagenu pre-mRNA 1 —2 m-RNA m-RNA rybosom- błona siateczki śródplazmatyc
SNB13904 udaremnione. Nie jest to związek specyficzny tylko dla opieki i wychowania, j istota i sens
IMGA49 Jąderko * Nie jest otoczone błoną ■ Stanowi zbiór cząstek rybosomalnych ■
związek samorządowy. Społeczność lokalna zostaje w ten sposób upodmiotowiona. Gmina zaś nie jest
DSC00090 reprezentujący ten nurt podkreślali, że związek organizacji z otoc* f niem jest dwustronny.
Związek pracy z potrzebami fizjologicznymi jest bardzo podstawowy. Głównie dzięki pracy ludzie zdoby
mit33 2 urn grzebienie mitochondrialne DNA rybosomy błona tylakoidu CHLOROPLAST błona błona
zwiazek przynaleznosci ZWIĄZEKPRZYNALEŻNOŚCI Związek przynależności — człon podrzędny jest nieodmien
związek ZWIĄZEK Twoją najważniejszą relacją jest związek z sobą samym i z Bogiem, a wszystkie inne w
ObrazE129 G9 Rybosomowy RNA Hasła I ■ Rybosomy ~1 Prokariotyczny rybosom 70S zbudowany jest z dwóch
DSC00428 2 ■ 26. Który związek nie jest stosowany w leczeniu nadwrażliwości zębiny
więcej podobnych podstron