CCF20100422�011

Hf
dziura
oksyanionowa
tetraedryczny produkt pośredni
r2
,'n t^r,
-'-0 • +h ~n/^n-H h
acyloenzym
R2—N hnh
o
\\
dziura
oksyanionowa
i;
O
-0'--n-N^N
acyloenzym
HjO
V
tetraedryczny produkt pośredni
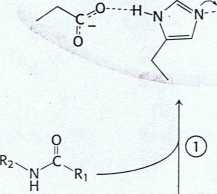
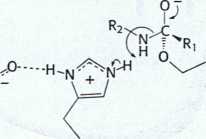
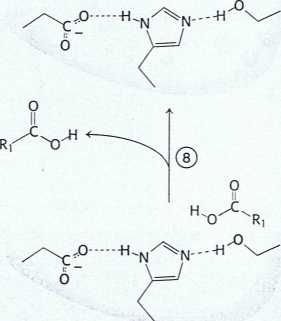
Rys. 9.8 Hydroliza peptydu przez chymotrypsynę. Mechanizm hydrolizy peptydu ilustruje zasady katalizy kowalencyjnej i katalizy kwasowo-zasadowej. Reakcja przebiega w ośmiu etapach: (1) wiązanie substratu, (2) atak nukleofilowy seryny na grupę karbonylową wiązania peptydowego, (3) rozpad tetraedrycznego produktu pośredniego, (4) uwolnienie składnika aminowego, (5) wiązanie wody, (6) atak nukleofilowy wody na produkt pośredni w postaci acyloenzymu, (7) rozpad powstałego tetraedrycznego produktu pośredniego i (8) uwolnienie kwasu karboksylowego. Zielone linie przerywane przedstawiają wiązania wodorowe.
z enzymu (etap 4), co kończy pierwsze stadium reakcji hydrolizy - acylację enzymu.
Kolejne stadium - deacylacja rozpoczyna się, kiedy cząsteczka wody zajmuje miejsce zajmowane uprzednio przez składnik aminowy substratu (etap 5). Grupa estrowa acyloenzymu ulega hydrolizie w procesie stanowiącym w istocie powtórzenie etapów od 2 do 4. W tych warunkach reszta histydyny 57 działa jako uniwersalny katalizator kwasowy i usuwa proton z cząsteczki wody. Powstała grupa OH- atakuje atom węgla grupy karbonylowej w obrębie grupy acylowej, co prowadzi do utworzenia tetraedrycznego produktu pośledniego (etap 6). Rozpad tej struktury umożliwia powstanie produktu zawierającego grupę karboksylową (etap 7). W końcu dochodzi do uwolnienia owego produktu (etap 8) i enzym jest gotowy do następnego cyklu katalizy.
Przedstawiony mechanizm odpowiada za wszystkie charakterystyczne cechy działania chymotrypsyny, z wyjątkiem obserwowanego wybiórczego rozcinania wiązań peptydowych po karboksylowej stronie reszt aminokwa-sowych z dużymi hydrofobowymi łańcuchami bocznymi. Badania struktury przestrzennej chymotrypsyny oddziałującej z analogami substratu i inhibitorami doprowadziły do odkrycia głębokiej i stosunkowo hydrofobowej kieszeni, nazywanej kieszenią Sj, do której dopasowane są długie i pozbawione ładunku łańcuchy boczne reszt takich jak fenyloalania i tryptofan. Związanie właściwego łańcucha bocznego w obrębie tej kieszeni ustawia sąsiednie wiąza-
acyloenzym
dziura
wię?. .
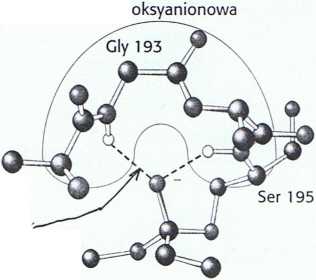
Rys. 9.9 Dziura oksyanionowa. Struktura ta stabilizuje tetraedryczny produkt pośredni reakcji katalizowanej przez chymotrypsynę. Zauważ, że wiązania wodorowe (kolor zielony) łączą grupy NH wiązań peptydowych z atomem tlenu produktu pośredniego, mającym ładunek ujemny.
247
Wyszukiwarka
Podobne podstrony:
P3109005 Czfit I. Wlidomokł wstępne Dobra produkcyjne pośrednio zaspokajają potrzeb)- człowieka. gdy
P1060824 Do czego wykorzystywane są produkty pośrednie powstałe w cyklu Krebsa? •
Zdjecie0502 Żelazo spuszczane z wielkiego pieca nosi nazwę surówki.Jest to produkt pośredni w p
4) nie uwalniają produktów pośrednich do środowiska, 5) nie mają
13 (73) Metody badania popytu na innowacje produktowe: - pośrednie, poprzez obserwacje popytu i poda
CCF20100308�002 Zasady i metody obliczania zdolności produkcyjnej Celem obliczenia zdolności produkc
CCF20100308�007 Stopień wykorzystania posiadanej zdolności produkcyjnej przedsiębiorstwa (ogniwa wyt
CCF20100322�001 (2) Pierwsze trzy elementy systemu produkcyjnego nazywane są podsystemem przetwarzan
CCF20100322�007 Kryteria organizacji i projektowania systemów produkcyjnych Cele organizacji: -jakoś
CCF20100504�000 Hf Utó, - 07? z - ]o S °0 01 MA0 - ®H? ćF1^ = ^ =e^ d
CCF20110531�013 Oblewanie stali z (fe) oraz kadź pośrednia - ( c) f17 *ezPWed
0000060 2 ku 39 zawiera układy a- i y-jononu i jest produktem pośrednim w czasie syntezy a-karotenu.
substrat gen A i enzym I bezbarwny produkt pośredni gen B enzym II barwnik antocyjanowy
Zdj cie012 Zidentyfikuj produkt końcowy i produkty pośrednie, nazwij j Zad 1 (1.4 pkt) Mg • wter CO,
Zdj cie013 (1) KOLOKWIUM I Zidentyfikuj produkt końcowy I produkty pośrednie, nazwi Zad.1 (1.4 pkt)
więcej podobnych podstron