CCF20120111�025

Niech początkowe dlmeme wynosi j%„ a ilość NgO® ■•--- n. Ody cm-
Madowi ulegnie ułamek a cjsąRteceek N^Os? wówczas pozostanie idi (1 •■•• «s)n* 3® śieeltfc»metrfi reakcji wynika (w szoegeiiK>śd z 1 mała N^Oa powstają 2 mole KOs i 1/2 mola Os)> ie Ilość powstałego ND2 będzie dwukrotnie wiąkssa od ilości mzbteego N$0$t eąvlt wyniesie 2<m, a ilość Og......|cm< M więc- w dowolnym
«ma»de rmkcji ilości skhidnikdw mieszaniny reagującą! będą równe;
KaO§ HOa Oa Sumą Ilość (1 '«■ o)ó. 2rt» |mi (1 ~h |t»)n
Olnkak całkowite (o ile temperatura i objętość uą stałe, a gazy zachowują ;?i<| jak dW^imle) Jest proporcjonalne do Ikssby csąstecaek w fazie gagowej. Ody o - 0, dmieme wynosi pp, zatem w kardy m pd&mejsKym momencie reakcji
P - (i + |«)po
Hapnykład, gdy reakcja dobiega, do kotka (stan równowagi reakcji rozpadło H$0§
jeśt' ta silnie przesunięty na prawo posyp. thtm.f, tx ~ 1 i etlmesie wzrośnie do
§/*2śwej początkową! wartości (Rys. 7J). Gdy znamy ilość Na0$ wprowadzonąćb
zbiornika* wówc&m mtśemy oblk&yć Ilości NnQ$, N(fa i (h W dowolnym mmfmos t zależności
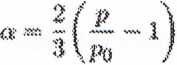
i a wyrażeń podanych powyżej.
26. Za pomocą jakich metod można obserwować przebieg reakcji?
27. Na czym polega analiza w czasie realnym?
28. Na czym polega zamrożenie reakcji?
mą- mmrośem# reaJwsji, fcj. raptoww f jąi &ajmM.€twMdd po opływie dkr^fc:-•: itego emsu, tak by móc bet polpicy <ku dokonać analizy składu. Zmmim* ate (bądi w całej nforaamnfe reagującej, bądź w pobranej próbce) oiózm : osiągnąć pmet gwałtowne oziębkalą ■ szybkie amk«attń> a dmą ilością roz« pumwMmkM lub zobojętnienie, gdy jeden z su tetrat-dw jeat kwasem- Spo- ;
29. Co jest niedogodnością metody przepływu? konieczność użycia znacznych objętości roztworu substratów
Wyszukiwarka
Podobne podstrony:
Image103 Stan 1 Maksymalna wartość rezystancji R0 w tym układzie wynosi: „ _
ARCHIWIZACJA X Napęd (USB DISK(Dev1) ~^ Typ Początek Koniec Wszystko ▼ Kanał
17 0.3. CIĄGI LICZBOWE Twierdzenie 0.3.7 (O arytmetyce granic) Niech ciągi (an)^=1 (b„)^=1 będą ciąg
2 W reakcji drugiego rzędu (A + B — produkty) stężenia początkowe substratów wynos
Jeżeli stężenie roztworu wzorcowego wynosi „ cwz” [mol/1], a jego miareczkowana objętość
Kolokwium Algebra II rok WMS Zadanie 1. Niech A = {a + bi + cj + dk : a,b,c.d € R}, pomiędzy liczbam
17 0.3. CIĄGI LICZBOWE Twierdzenie 0.3.7 (O arytmetyce granic) Niech ciągi (an)^=1 (b„)^=1 będą ciąg
O a„ - ilość sprzedanych akcji 0 Poj - cena emisyjna jednej akcji uprzywilejowanej 0 &nb
7. Wektory losowe7.1. Rozkłady dwuwymiarowePrzykładyPrzykład 7.1.1. Niech ,, X fc^+y2) dla (x,y) €
CCF20100330�009 T1 I
17 0.3. CIĄGI LICZBOWE Twierdzenie 0.3.7 (O arytmetyce granic) Niech ciągi (an)^=1 (b„)^=1 będą ciąg
Wydajność punktów przeładunkowych transportu intermodalnego wynosi: —»żadne+ a)
CCF20100221�018 OfooLuJ^dt P V t1* a*?*’- -KrUŁ# „ j/if ^
CCF20110123�026 (2) A/n 0 1. A, aó iira p^uncćKJź&ćJytS) z£j^6ou^q™j cs} O^Ą r/ć/?)i& n?a
więcej podobnych podstron