Obraz0020

i .iidii';i -1.1. Stule w równaniu vuti (ter Waaisi
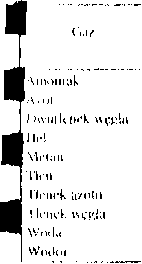
|
W Ali |
M0'\ | |
|
N ■ nć |
m’ | |
|
mol' |
mul _ | |
|
' nm! |
0.4235 |
0,o.c/7~'’~ |
|
Ni |
0J40S |
0,0391 |
|
CO, |
O.UoS |
0.0429 |
|
Ho |
0.0045 |
0.0234 |
|
Cl fi |
0.228 1 |
0,0 0,8 |
|
(fi. |
0.1378 |
0.0318 |
|
NO |
0,1301 |
0,0279 |
|
CO |
0.150*) |
0.0309 |
|
41,0 |
0.57% |
0,0319 |
|
11, |
0,0240 |
0.02W) |
□ równanie wirialnc, w postaci szeregu Kamcriingha-Onocsa
I 4
tU I ) f(T) DCI )
T - 4 -V.- "
V V' v-
(4,2)
jn 1/ie: ściśliwość lut) współczynnik ściśliwości, charakteryzujc w pew
nym stopniu odchylenie substancji rzeczywistych od modelu gazu doskonal ego {CM apey ron a),
B(T) ■- drugi współczynnik wirialny, odpowiada uwzględnieniu oddziały wnń między dwiema cząsteczkami,
C(T) - trzeci współczynnik wirialny, odpowiada uwzględnieniu oddziaływań między trzema cząsteczkami itd.
Współczynniki wirialne wyznacza się empirycznie lub przy pewnych założeniach oblicza się teoretycznie metodami fizyki statystycznej.
□ inne postacie równania stanu gazu rzeczywistego, często wykorzystywane, to równanie Penga-Robinsona (PR), równanie Redlicha-Kwonga (RK), równania Beattie-Bridgemana (BB) i Benedtcta-Webba-Rubina (BWR) oraz ich modyfikacje.
4.2. Równanie stanu van der Waalsa
Równanie van der Waalsa (vdW) można doprowadzić do postaci bezwy ............: cif1 od nrzvieteco układu jednostek. Wprowadza się para '
Pr
|
JL |
v,=X |
Tr=X | |
|
Pfc ’ |
Vk |
P ł |
Tk |
(4.3)
j.;l,u stosunki znamion: p, V, T odpowiednio do znamion w termodynamicznym [-unUtc krytycznym: pfc, Vk, Tk. Znamiona krytyczne dia równania vdW okre-(nn równania:
IK -
21 bi
Vk-3b„, Tk
27bnR
(4.4)
)' » podstawieniu równań (4.3) i (4.4) do (4.1) i przekształceniu otrzymuje sic1 o■!łukowane równanie van der Waalsa
(4.5)
-(3Vr-I) = 8Tr ii.imnm krytyczne podano w tabl. 4,i
tablica 4.2. Wartości znamion stanu krytycznego niektórych substancji
|
Substancja |
Wzór chemiczny |
Tk |
Pk | |
|
K |
MPa |
kg nr' | ||
|
Acetylen |
C;Hi |
309,2 |
6,28 |
231 |
|
Amoniak |
NHj |
405,6 |
11,30 |
235 |
|
Argon |
Ar |
151.1 |
4,86 |
531 |
|
Azot |
Nj |
126,1 |
3,37 |
311 |
|
Benzen |
CtXh |
561,7 |
4,83 |
304 |
|
Chloroform |
CHC13 |
534,1 |
5,56 |
5(6 |
|
Dwutlenek azotu |
no2 |
114,4 |
10.13 |
560 |
|
Dwutlenek starki |
so2 |
430,4 |
7.87 |
520 |
|
Dwutlenek węgla |
co2 |
304,2 |
7,40 |
460 |
|
Etan |
c3H6 |
305,4 |
4,88 |
210 |
|
Etanol |
C.H^OH |
516.3 |
6,39 |
275 |
|
Het |
He |
5,3 |
0,23 |
69 |
|
Metan |
ch4 |
190,7 |
4,64 |
162 |
|
Naftalen |
cl0ih |
741,4 |
3,97 |
314 |
|
Neon |
Ne |
44,5 |
2,62 |
484 |
|
Tlen |
O, |
154,4 |
5,04 |
430 |
|
Tlenek węgla |
CO |
133,0 |
3,50 |
310 |
|
Toluen |
CfjHjCHj |
593,8 |
4,22 |
292 |
|
Woda |
h2o |
647.3 |
22,13 |
323 |
|
Wodór |
m2 |
33,3 |
1,30 |
31 |
Wyszukiwarka
Podobne podstrony:
Obraz0021 Najdogodniejszą postacią równaniu .stanu gazu rzeczywistego jest zmodyfikowane równanie Cl
P1200350 Mmct* «*«*»«• (netem wywfcać* Q ter, wn<a fab Md» Q Muwrly(«M?r>
mame ** MAME32 File View Options Help _J Ali Games Gamę 3 ■~M Available " 1 Clones + Ij
mame ** MAME32 File View Options Help _J Ali Games Gamę 3 ■~M Available " 1 Clones + Ij
28742 smpb 42 No othcr man hu evcr poscd for thc many statucs that I havc. Wcrc I to show ali thc mo
Obraz0002 Zadanie nr 2 Wstawić za pomocą programu Microsoft Equation 3.0 (Edytor równań) następujące
Obraz0015 U) Chcąc obliczyć ciepło przemiany izobarycznej dla guzów pófdoskonałycii, niik/,y w równa
Obraz0025 Ciepło przemiany izochorycznej oblicza się z równania pierwszej zasad;, termodynamiki okre
Obraz0038 I (6.6) (6.7) (6.8) (6.9) (6.10) (6.1!)
Obraz0042 82 Z równań tych można określić zawartość wilgoci w strumieniu mieszań oraz jej entalpię
Obraz0241 241 Zmianę prądu ic w obwodzie ładowania można wyznaczyć bezpośrednio przez przekształceni
img235 Równanie parametryczne prostej wyznaczonej punktami A, B (A * B) X=A + t(B-A), teR równanie s
alg ter 2 04-09.2013 ALGEBRA 12/13 - Egzamin - Termin 2 Zad 1) [lOp] a) Rozwiąż układ równań w zależ
więcej podobnych podstron