0117

się stan stacjonarny przy różnicy potencjałów elektrycznych, zwanej potencjałem dyfuzyjnym, wyrażającym się wzorem Hendersona
&V =
5.18
Wielkości «T i M_ oznaczają ruchliwości jonów, odpowiednio kationów i anionów. Ruchliwość jonu dełiniuje się stosunkiem prędkości v jonu, do natężenia pola elektrycznego w którym się jon porusza, jest więc
m
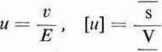

m
Ruchliwość jonu lepiej od jego prędkości charakteryzuje właściwość jonu. Prędkość jonu jest proporcjonalna do natężenia pola elektrycznego, ruchliwość, równa liczbowo prędkości jonu w polu jednostkowym, od natężenia pola nie zależy.

Chcąc otrzymać wzór 5.18 należy układ traktować w stanie nierównowagi, dyfuzja jest przecież zjawiskiem nieodwracalnym, tworzącym entropię. Bodziec, różnica potencjałów chemicznych Ag daje przepływ dyfuzyjny jonów Jd, ten przepływ związany jest z ruchem nabojów elektrycznych stanowiącym przepływ sprzężony Je, prowokujący nowy bodziec w postaci różnicy potencjałów elektrycznych if. Proces można opisać dwoma równaniami fenomenologicznymi

Jd = LdA[i + LdcAy 5.19
Ryc. 5.4. Potencjał dyfuzyjny. Różnica szybkości przemieszczania się kationów i anionów zapoczątkowuje powstawanie skoku potencjałów na styku roztworów.
Je = LcdA)x + LeAV 5.20
W stanie stacjonarnym jest Je = 0, wtedy z 5.20 wynika
AK = — ^-A|i 5.21
L-e
Zakładając A|x = 0 z równań 5.19 i 5.20 otrzymuje się
Jd
Je
5.22
Wypadkowy przepływ substancji Jd, jako wynik poruszania się jonów dodatnich w jedną a ujemnych
1 (dnr d«+\
w drugą stronę, można przedstawić zależnością Jd — — I---
S \ dl
I. Przepływ ładunku elektrycznego
d/ )
Jc, na który składa się ruch nabojów dodatnich i ujemnych, wyrazi się zależnością Jc = —--= — - zt
S dr S
. gdzie dii = ~F ■ dn jest nabojem elektrycznym związanym z liczbą d/i moli ionów od-
pow iednio jednego i drugiego znaku, przepływającym w czasie dl przez powierzchnię S. Jeśli się zwróci uwa-
I dn
Bć, że - — = c„,v
s dr
d/i d K
jest bowiem — = c„. -
dr dr
dK ,
a —— = Si; I to: Jd = c,„(v - — v ),
124
Wyszukiwarka
Podobne podstrony:
strona: 7 posługuje się danymi katalogowymi przy doborze materiałów elektrotechnicznych analizuje
strona: 7 posługuje się danymi katalogowymi przy doborze materiałów elektrotechnicznych analizuje
0000013 (17) Przy określonej różnicy potencjałów między metalem a elektrolitem ustali się stan równo
różnicę potencjałów istniejącą między elektrodami 1 i 2, a ta jest równa wynikowi dodawania się w ka
Jak już wspomniano, różnicę potencjału w warstwie dyfuzyjnej określa się pc cjałem elektrokinetyczny
Elektryczność Miarą pracy przy przesunięciu ładunku między punktami o różnicy potencjałów U, jest
P1050526 u ELEKTRODY 129 się z nim roztworu. Wytwarza się różnica potencjałów, po ustaleniu której l
348 [1024x768] OGNIWA GALWANICZNE 357 Na zaciskach elektrod platynowych pojawi się teraz różnica pot
DSCN5673 Różnica potencjałów Vab między dwoma punktami a i b w polu elektrycznym E wyraża się c
więcej podobnych podstron