0018 2
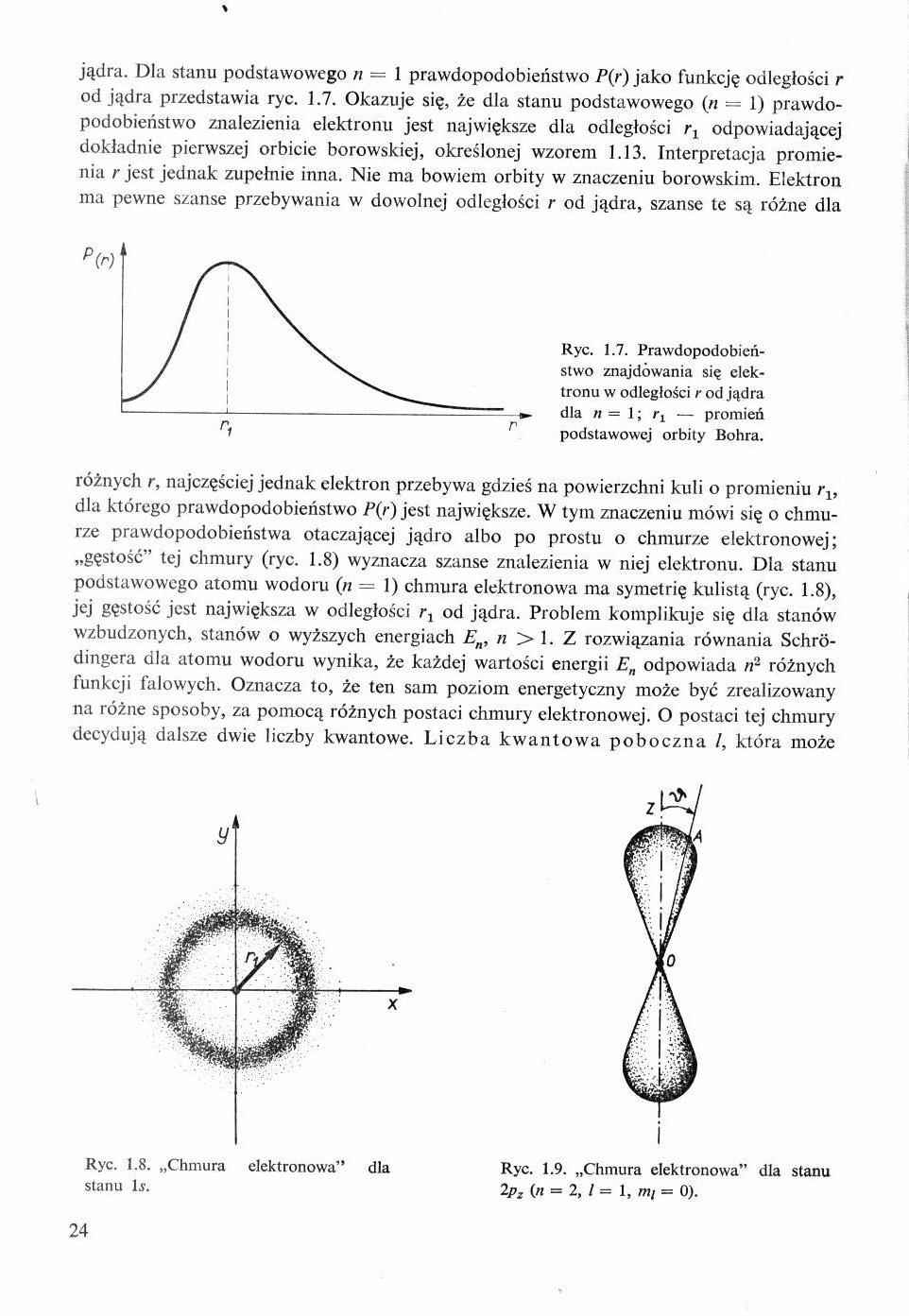
jądra. Dla stanu podstawowego n = 1 prawdopodobieństwo P(r) jako funkcję odległości r od jądra przedstawia ryc. 1.7. Okazuje się, że dla stanu podstawowego (n - - 1) prawdopodobieństwo znalezienia elektronu jest największe dla odległości r, odpowiadającej dokładnie pierwszej orbicie borowskiej, określonej wzorem 1.13. Interpretacja promienia r jest jednak zupełnie inna. Nie ma bowiem orbity w znaczeniu borowskim. Elektron ma pewne szanse przebywania w dowolnej odległości r od jądra, szanse te są różne dla
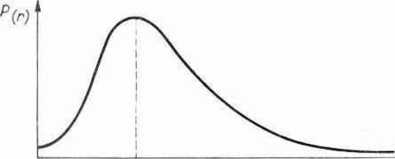
Ryc. 1.7. Prawdopodobieństwo znajdowania się elektronu w odległości r od jądra dla n = 1; z-! — promień podstawowej orbity Bohra.
różnych r, najczęściej jednak elektron przebywa gdzieś na powierzchni kuli o promieniu rlt dla którego prawdopodobieństwo P(r) jest największe. W tym znaczeniu mówi się o chmurze prawdopodobieństwa otaczającej jądro albo po prostu o chmurze elektronowej; „gęstość” tej chmury (ryc. 1.8) wyznacza szanse znalezienia w niej elektronu. Dla stanu podstawowego atomu wodom (n = 1) chmura elektronowa ma symetrię kulistą (ryc. 1.8), jej gęstość jest największa w odległości r, od jądra. Problem komplikuje się dla stanów wzbudzonych, stanów o wyższych energiach En, n >1. Z rozwiązania równania Sehró-dingera dla atomu wodoru wynika, że każdej wartości energii En odpowiada n2 różnych funkcji falowych. Oznacza to, że ten sam poziom energetyczny może być zrealizowany na różne sposoby, za pomocą różnych postaci chmury elektronowej. O postaci tej chmury decydują dalsze dwie liczby kwantowe. Liczba kwantowa poboczna /, która może
y

X
Ryc. 1.8. „Chmura elektronowa” dla stanu 1a-.
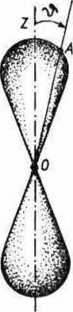
Ryc. 1.9. „Chmura elektronowa” dla stanu
2pz (« = 2, / = 1, m, = 0).
24
Wyszukiwarka
Podobne podstrony:
049 3 Równanie stanu 49 zapisane jako wektor x(t), zależą od położenia początkowego i prędkości pocz
045 2 Operatory odległości realizują funkcję odległości od zadanego obiektu (obiektów). Typowym oper
HWScan00244 Podstawowe obciążenie wiatrem przyjmuje się niezależnie od wysokości ustroju dla stanu n
skanuj0138 (11) Rys. 2.13. C„ i dCn/dn jako funkcja n dla foremnych schematów koordynacyjnych. Można
Slajd30 (43) Stwierdzenie to można zapisać jako funkcję A, E i C, f(A, B, C). Przykładowo dla punktó
img087 7.1. Podstawowe sformułowanie metody funkcji potencjalnych 87 Rys. 7.2. Funkcja przynależnośc
Wojciech Jurczak Dla stanu ta: - w środowisku obojętnym otrzymano następujące funk
50 Pasy linii pozycyjnych, rozpatrywane jako funkcje rozkładu prawdopodobieństwa, przedstawiają się
Podstawowe równanie RUCHU wyrażające II prawo Newtona dla zawiesiny. Traktując cząsteczkę jako ciało
Potencjał V jako funkcja r dla wydrążonej kuli o promieniu R i odpowiadające mu pole elektryczne E (
034 4 t Ryc. ti Prawdopodobieństwo PU) znajdowania uę elektronu w odległości z od jądra dla n ■ 1; r
97 (43) 4. Ciągi liczbowe4.1. PODSTAWOWE WŁASNOŚCI CIĄGÓW a) Funkcja 4.1.1. Ciąg jako funkcja
więcej podobnych podstron