arkusz4 2

|
Rząd |
Reakcja |
Równanie kinetyczne |
Scałkowane równanie kinetyczne |
Czas połowicznej przemiany |
|
0 |
A -> P |
v = k |
c0 — c = k t |
T _ C0 T,/2"2k |
|
1 |
A -* P |
v = k • c |
u li 3 |
ln2 '■/2= |
|
2 |
A -> P |
v = k • c2 |
1 1 . ---= k -1 c c0 |
O U II W* |
|
A + B -> P |
v = k cA -cB Ca« ^ C|k) |
1 ta(c*,-x)cBo, u.t cAo cBo c^0 • (cBo X) |
nic istnieje | |
|
3 |
A P |
v = k • c3 |
' - 1 =k.< 2c2 2c02 |
3 xI/2 = , 2 • k•c02 |
|
r (r* 1) |
A -* P |
v = k • cr |
1 f 1 1 ) , (r-l)[c'-> c/-1 j " |
lr l -1 "n |
Należy pamiętać, że jednostka stałej szybkości jest inna dla każdego rzędu reakcji.
Jak wspomniano rząd reakcji wyznacza się zawsze eksperymentalnie. Istnieje wiele metod wyznaczania rzędu reakcji chemicznej.
• Metoda podstawienia do wzoru. Bada się stężenie wybranego reagenta w kolejnych, określonych czasach t|, tj, tj itd., a następnie podstawia otrzymane wartości stężeń ci, C2, ej itd. do scałkowanych równań kinetycznych i oblicza wartość k. Jeśli dla równania opisującego reakcję pierwszego rzędu otrzymamy w przybliżeniu jednakowe jej wartości, to możemy stwierdzić, że reakcja jest rzeczywiście pierwszego rzędu. Jeśli nic, to ponawiamy obliczenia korzystając z równania scałkowancgo dla drugiego rzędu. Procedurę tę powtarzamy, aż dane doświadczalne dadzą się dopasować do równania określonego rzędu. Odmianą tej metody jest metoda graficzna. Scalkowanc równania kinetyczne można przedstawić w postaci linii prostej w odpowiednim układzie współrzędnych :
0 rząd c = c0 - k • t
1 rząd ln c = ln c0 - k ■ ł
2 rząd - = — + k -1
c
, .1 1 , ,
3 rząd — = —- + 2 k • t
c co
Kreślimy zależności c = f(t), ln c = f(t)= f(t).-^- = f(t) i badamy, dla którego
c c
układu współrzędnych dane doświadczalne najlepiej pasują do linii prostej.
■ Metoda różniczkowa van’t Hoffa. (idy stężenia początkowe wszystkich reagentów są jednakowe, to :
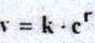
(idy zmierzymy szybkość reakcji dla dwu różnych stężeń subslratu, to rząd reakcji mo żerny znaleźć z równania :
i vj
ln *
r =
_
ln'2
Wyszukiwarka
Podobne podstrony:
Wyprowadzenie wzoru na rząd reakcji (metoda różnicowa Van’t Hoffa) Jeżeli równanie kinetyczne ma pos
453 [1024x768] ILOŚCIOWY OPIS SZYBKOŚCI REAKCJI CHEMICZNYCH Po scałkowaniu tego równania kinetyczneg
DSC02179 (2) 7. Rząd reakcji suma wykładników potęgowych stężeń substratu w równaniu kinetycznym, dl
szybkości reakcji, stała szybkości reakcji, równania kinetyczne, prawo Arrheniusa, procesy aktywowan
Klasyfikacja kinetyczna reakcji chemicznych Rząd reakcji - suma wykładników potęgowych ze stężenia
55664 s 125 16. KINETYKA REAKCJI CHEMICZNYCH Kinetyka chemiczna zajmuje się badaniem szybkości reakc
r fore z poniższych równań reakcji poprawnie przedstawia powstawanie czadu pod czas spalania metanu?
P1040126 Zależności pomiędzy stałymi równowagi Dla reakcji o równaniu: aA + bB -» dD + eE stałe równ
6. Wpływ temperatury na szybkość reakcji. Równanie Arrheniusa. Teoria zderzeń
DSC02177 Kinetyka reakcji chemicznych 1. Kinetyka chemiczna zajmuje się szybkością
CCF20120112�000 42. Jakie są oznaczenia osi na wykresie pozwalającym wyznaczyć rząd reakcji metodą s
Egz rurki1 EGZAMIN ZE WSTĘPU DO TEORII RÓWNAŃ RÓŻNICZKOWYCH Czas pracy: 120 min. Test wielokrotnego
Scan137 [50 Jaki będzie rząd reakcji względem A w tych warunkach? (Reakcja przebiega wolno, układ je
Rząd reakcji Rząd reakcji może być 0, ułamkowy całkowity = a + b +... całkowity = a + p
więcej podobnych podstron