CCF20110121�194

[£>Beata Ostrowska [£> Twoja matura - chemia
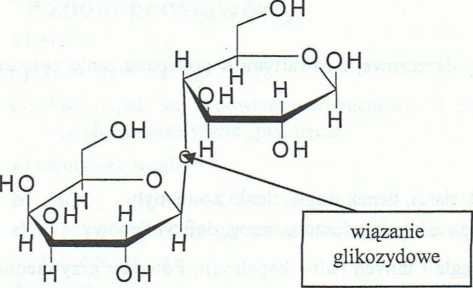
C12H22O11 + H2O * CgH^Oń + C6Hi206
laktoza + H20 —> D-galaktoza + D-glukoza I produkt II produkt
7. A-I B - ni C-H D - IV
8. W procesie denaturacji niszczone są wszystkie wyższe struktury białkowe (drugo-, trzecio- i czwartorzędowe). Zniszczeniu ulęgają wiązania wodorowe, estrowe, disiarczkowe i oddziaływanie kation-anion.
9. Opis doświadczenia:
sprzęt laboratoryjny: dwie probówki, pipety, palnik, łapa drewniana do probówek
odczynniki chemiczne: wodne roztwory glukozy i sacharozy, wodorotlenku sodu, azotanu(V) srebra, amoniaku przebieg doświadczenia: Do dwóch odtłuszczonych probówek wprowadzamy kolejno roztwory azotanu(V) srebra, amoniaku (do rozpuszczenia pojawiającego się osadu), a następnie roztwory cukrów: do jednej glukozę, a do drugiej sacharozę. Probówki podgrzewamy w płomieniu palnika.
obserwacje: Probówka z glukozą pokrywa się warstwą metalicznego srebra, zaś w probówce z sacharozą obserwujemy jedynie pojawienie się czarnego osadu powstałego na skutek temperaturowego rozkładu odczynnika Tollensa.
wnioski: W probówce pokrytej srebrem znajduje się glukoza - cukier redukujący, w drugiej sacharoza - cukier nieredukujący.
XVII.Chemia i jej wpływ na kształtowanie środowiska oraz jego ochronę Poziom podstawowy
1. Wystarczy w wodzie rozpuścić trochę mydła. W wodzie twardej natychmiast wytrąci się biały osad stearynianu wapnia lub magnezu. W wodzie miękkiej mydło po prostu się rozpuści.
2C17H3SCOO" + Ca2+ -> (C17H3sCOO)2Ca4r
2. Wodorowęglan wapnia podczas gotowania wody w czajniku rozkłada się z wydzieleniem nierozpuszczalnego węglanu wapnia.
Równanie reakcji chemicznej: Ca(HC03)2 -» CaC034 + CO2 + H20
3. 1 - A 2 - C 3-D 4 - B
4. a) spaliny samochodowe
b) rozkład skał wapiennych
c) oddychanie ludzi i zwierząt
d) elektrociepłownie
Wyszukiwarka
Podobne podstrony:
s 85 pcx o Beata Ostrowska tt> Twoja matura - Chemia 10 .W tabeli podano wartości stałych dysocja
CCF20110121�001 U> Beata Ostrowska [£> Twoja matura - ChemiaSpis
CCF20110121�003 D> Beata Ostrowska [£> Twoja matura - ChemiaBudowa atomu i promieniotwórczośćP
CCF20110121�005 B> Beata Ostrowska [£> Twoja matura - Chemia Pisać konfiguracje trwałych jonów
CCF20110121�033 [£> Beata Ostrowska [£> Twoja matura - Chemia 10 .Do probówki zawierającej roz
CCF20110121�013 l> Beata Ostrowska [£> Twoja matura - Chemia b) Jak zmienia się aktywność meta
CCF20110121�015 {£> Beata Ostrowska [£> Twoja matura - Chemia Logicznie analizować dane
CCF20110121�019 n> Beata Ostrowska [£> Twoja matura - ChemiaWiązania chemicznePoziom rozszerzo
CCF20110121�021 U> Beata Ostrowska [£> Twoja matura - Chemia Rozumieć istotę różnic w
CCF20110121�023 IV. [£> Beata Ostrowska [£> Twoja matura - ChemiaReakcje chemiczne i zjawiska
CCF20110121�025 5. d> Beata Ostrowska [£> Twoja matura - Chemia Pisać pełne równania reakcji o
CCF20110121�027 [J> Beata Ostrowska [£> Twoja matura - Chemia b) Podaj wzory produktów organic
CCF20110121�029
CCF20110121�031 [[> Beata Ostrowska [£> Twoja matura - Chemia 4. Wiedząc, że metan jest gazem
CCF20110121�035 H> Beata Ostrowska
CCF20110121�037 [£> Beata Ostrowska [£> Twoja matura - Chemia Projektować doświadczenie chemic
CCF20110121�041 O Beata Ostrowska [£> Twoja matura - Chemia 0-1 p. 0-1 p. c) Podaj nazwę
CCF20110121�051 n> Beata Ostrowska [£> Twoja matura - Chemia b) Której z substancji Li2C03 czy
CCF20110121�053
więcej podobnych podstron