CCF20110121�033

[£> Beata Ostrowska [£> Twoja matura - Chemia
10 .Do probówki zawierającej roztwór wodny manganianu (VII) potasu wprowadzono heksen. Roztwór odbarwił się, a w probówce pojawił się brunatny osad. Napisz równanie zachodzącej reakcji chemicznej w postaci jonowej i cząsteczkowej. Dobierz współczynniki metodą bilansu elektronowego.
Zapisywać równanie reakcji chemicznej na podstawie opisu słownego.
0-4 p.
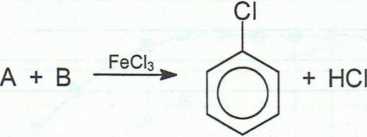
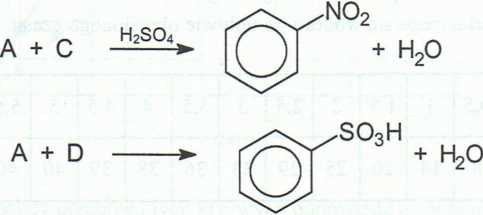
11. Podaj wzory substancji A, B, C i D oraz ich nazwy.
12. Poniżej podano równania reakcji i entalpie tworzenia substancji. Podziel podane reakcje na egzo- i endoenergetyczne. Określ, czy dana reakcja może przebiegać samorzutnie.
a) Ag + 1/2 Br2 AgBr AH° = -99,49 kJ/mol
b) C + 2S ** CS2 AH° = 257,5 kJ/mol
c) Ca + S 5F* CaS AH° = -475,0 kJ/mol
a) _
b) _
c) _
13. Wiedząc, że podczas reakcji:
C2H6 + 7/202 -> 2C02 + 3H20 AH° =
wydziela się duża ilość energii, co może grozić wybuchem znak „+” lub przy podanej wartości entalpii.
_ 1560,51 kJ
jądź pożarem, wstaw
IV. Reakcje chemiczne i zjawiska fizyczne, właściwości substancji... - Poziom rozszerzony
Przewidywać substraty reakcji organicznych na podstawie zapisanego schematu reakcji.
0-4 p.
Rozróżniać reakcje egzo
-i endoenergetyczne.
0-1 p.
Znać kryterium samorzutności procesów chemicznych.
0-2 p.
Rozróżniać reakcje egzo-
i endotermiczne.
0-1 p.
Wyszukiwarka
Podobne podstrony:
s 85 pcx o Beata Ostrowska tt> Twoja matura - Chemia 10 .W tabeli podano wartości stałych dysocja
CCF20110121�063 u> Beata Ostrowska [£> Twoja matura - Chemia Stężenie procentowe i stężenie mo
CCF20110121�087 [£> Beata Ostrowska [£> Twoja matura - Chemia 10. Podaj wzory dowolnych, wybra
CCF20110121�178 [£>Beata Ostrowska [£> Twoja matura - chemia 10. a) 3C + 4HN03 -> 3C02 + 4N
CCF20110121�001 U> Beata Ostrowska [£> Twoja matura - ChemiaSpis
CCF20110121�003 D> Beata Ostrowska [£> Twoja matura - ChemiaBudowa atomu i promieniotwórczośćP
CCF20110121�005 B> Beata Ostrowska [£> Twoja matura - Chemia Pisać konfiguracje trwałych jonów
CCF20110121�013 l> Beata Ostrowska [£> Twoja matura - Chemia b) Jak zmienia się aktywność meta
CCF20110121�015 {£> Beata Ostrowska [£> Twoja matura - Chemia Logicznie analizować dane
CCF20110121�019 n> Beata Ostrowska [£> Twoja matura - ChemiaWiązania chemicznePoziom rozszerzo
CCF20110121�021 U> Beata Ostrowska [£> Twoja matura - Chemia Rozumieć istotę różnic w
CCF20110121�023 IV. [£> Beata Ostrowska [£> Twoja matura - ChemiaReakcje chemiczne i zjawiska
CCF20110121�025 5. d> Beata Ostrowska [£> Twoja matura - Chemia Pisać pełne równania reakcji o
CCF20110121�027 [J> Beata Ostrowska [£> Twoja matura - Chemia b) Podaj wzory produktów organic
CCF20110121�029
CCF20110121�031 [[> Beata Ostrowska [£> Twoja matura - Chemia 4. Wiedząc, że metan jest gazem
CCF20110121�035 H> Beata Ostrowska
CCF20110121�037 [£> Beata Ostrowska [£> Twoja matura - Chemia Projektować doświadczenie chemic
CCF20110121�041 O Beata Ostrowska [£> Twoja matura - Chemia 0-1 p. 0-1 p. c) Podaj nazwę
więcej podobnych podstron