DSC09186
Dotychczasowe rozważania odnoszą się do elektrolitów o niskim stężeniu i prostym sldadzie, a więc przede wszystkim jednoskładnikowych. W praktyce spotyka się roztwory wieloskładnikowe i nieraz bardzo stężone. Powoduje to, że istnieją duże różnice między ■jsczywistym stężeniem aktywnych jonów wodorowych, a wynikiem pomiaru. Poza tym stosowane w praktyce przemysłowej elektrody charakteryzują często pewne rozbieżności względem założeń teoretycznych i indywidualne zmienności, zależność od temperatury oraz innych czynników.
Aby osiągnąć możliwie powtarzalne wyniki praktyczny pomiar stężenia jonów wodorowych powinien opierać się na porównaniu potencjału odpowiedniego ogniwa pomiarowego umieszczonego kolejno w roztworze wzorcowym i badanym. Można to zapisać w następujący sposób:
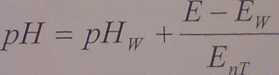
(17)
jgdzie:
I 1 pHw oznacza stężenie jonów wodorowych wzorca,
I - E oraz Ew - SEM ogniwa w roztworze badanym i wzorcowym.
Powyższy wzór jest podstawą wzorcowania elektrod.
Bardzo ważne jest to, aby zachować warunki wzorcowania bardzo zbliżone do warunków panujących w rzeczywistości. Oznacza to, że należy wybrać pHw=pH oraz zadbać, aby temperatury wzorca i roztworu badanego były identyczne.

_:_
Wyszukiwarka
Podobne podstrony:
Wartości współczynników Kx, K2 odnoszą się do elektrody roboczej wykonanej z miedzi przy użyciu naft
snuje rozważania na bardzo różne tematy, odnosząc się do dwudziestu trzech pisarzy
16 Alicja Sosnowska Z dalszych rozważań cytowanej autorki odnoszących się do treści i procesu budowy
Elektrochemia • kolokwium - wariant C Uwaga: Jeżeli nie podano inaczej, to wszycie dane odnoszą się
hejl2 69 cir.cje odnoszące się do 1938 czy 1968 roku. ?o obu stronach Karkonoszy i »Tatr historia w
Dokumentację dzielimy na: 1. Dokumentację medyczną indywidualną, odnoszącą się do
starca z pobliskiej wioski usłyszał legendę dotyczącą kurhanu, a odnoszącą się do czasów Tamerlana.
Dokumentację dzielimy na: 1. Dokumentację medyczną indywidualną, odnoszącą się do
skanuj0118 (7) AKSJOLOGIA LTYC/NA kich Mają przeto charakter powszechny i odnoszą się do w szystkich
img027 zasadę dobrowolności i otwartości służby, odnoszącą się do bezinte resownej solidarności ludz
img087 (18) 82,5 dziano iuż poprzednio 1 — władza odnosząca się do pewnego przedmiotu, ujętego pojęc
więcej podobnych podstron