skanuj0093

- 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych
- 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych
p‘K.a-7,20 p'Ka-11,9 p!K, = 9,25 pJK» = 4,76 pKw = 14
MMgNH,po. = 137 g/mol
Stała protolizy jonu amonowego Stała protolizy kwasu octowego Iloczyn jonowy wody Masa molowa MgNKiPO*
CZĘŚĆ A
MODEL STECHIOMETRYCZNY
W nasyconym roztworze trudno rozpuszczalnej soli MgNH+POł ustala się równowaga pomiędzy fazą stałą (stały MgNRjPO*) a roztworem jonów Mg2*, NH,+,P043':
+ ^ + (13.1)
W roztworze jon magnezu nie wchodzi w reakcje następcze. Natomiast jon amonu (słaby kwas Brónsteda) i fosforan(V) (słaba zasada Brónsteda) ulegają protolizie, przy czym proces ten nie przebiega do końca. W roztworze ustalają się
następujące równowagi:
P043“+ H20 u HP042"+OH- (13.2)
HP042" + H20 « HjPOT + Ol f (13.3)
HiPOr+HjO c H3PO4 + OH* (13.4)
NH4* + H2O » NHj + HjO* (13.5)
W roztworze zachodzi również reakcja autoprotolizy wody:
2H2O « H3O* + OH* (13.6)
Składniki roztworu: jony Mg2*, NH/, HjO*, PO^, HPO42-, H2PO4”, OH" oraz cząsteczki NHj, H3PO4 i HjO.
Faza stała: osad soli MgNFLPO*.
MODEL MATEMATYCZNY Opis równowagi
Równowagę reakcji (13.1) definiuje iloczyn rozpuszczalności:
Ks“cMg* CNHt cpo1- <13,7*
Równowagę reakcji protolizy kolejnych jonów ((13,2)-(13.4)) opisują stałe:
\v °HPO^ ‘COH-
(I3.H) '
(13.9)
(13.10)
(13.11)
w* »
(13.12)
roztworzą
03.13)
(13.14)
(13.15)
(13.16)
IVbi«-—--’»•
cpc^-
gdzie: 1 Kb, - L =
k*3
Następnie:
'K
b2
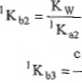
_ |q(-PKw H3PO4 ‘ CQH~
ch*po;
ch2po; 'coh~
CHPOj-
oraz:
- Kw -m(“PKw*P,,c««> k.u-T—-ro
*•*81
Stała protolizy jonu amonowego:
■Ł>V JK. =10-p,K‘
NHJ
Równowagąautoprotolizy wody (13.6) opisuje iloczyn jonowy wody K<
Kw-Vc«r K“ ",0“Kw
Bilans materiałowy
Rozpuszczalność, czyli formalne stężenie soli MgNHgPOg w nasyconym o* Jest równa:
- stężeniu jonów magnezu
-r. PnZSuf
- sumie stężenia jonów amonowych i amoniaku
°.=cnh;+cnh>
- oraz sumie stężenia jonów fosforanowych i produktów ich protolizy
c* "cpq5".+chpo5“ +CHjK>4 +C|hf°<
Bilans ładunków
^M*1' +cniij +ch,o* *=3Cp°i" +2cHroJ- +ch,po4 +Ooir
Wyszukiwarka
Podobne podstrony:
skanuj0094 5. Hównowłiął Junumi w rozctortc/onych roztworach wodnych Ocena kompletności modelu
29967 skanuj0074 (13) 144 5. KA»lumuglJonowe w rozdttkzonych roztworach wodnych S.3. Koiłwory kwasów
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0101 2 198 5. Równowagi jonowe vr rozcieńczonych roztworach wodnych pH - 8. Stężenie formalne
skanuj0102 2 200 5. Równowag jonowe w rozcieńczonych roztworach wodnych 22. Oblicz
skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocnych kw
skanuj0065 (15) MO 1 ^ł<c 126 _- S. Równowag jonowe w rozckricropydi roztworach
skanuj0072 (15) 140 5. Równowagi Jonowe ro/ctcrtczonych roztworach wodnych Bilans ładunków. Zgodni
skanuj0058 2 114 S. Równowagi joiwre w rozcieńczonych roztworach wodnych znanych jest kilka innych,
skanuj0060 2 118 5. Równowagi .tonowe w rozcieńczonych roztworach wodnychK, SOL Iloczyn
więcej podobnych podstron