094

Pr złócc J**l red pruł dr lubJ K. PtirownlcKgo"Podstawy loknbuk^i*. 'K\«r«.r*i 3006. ISBN k.V.>i;h-.ł|>2 0 C by WNT
dużym stopniu zahamowania AChK dochodzi do zatrucia w wyniku nagromadzenia się w synapsach i zakończeniach nerwowych acetylocholiny. Towarzyszą temu obwodowe objawy muskarynowc i nikotynowe oraz zaburzenia ośrodkowego układu nerwowego: zgon może nastąpić wskutek porażenia ośrodka oddechowego
Rysunek 4.4
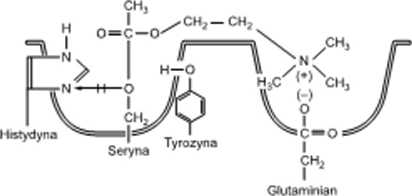
Cze# Cze#
esterazom amonowa
Model centrum aktywnego AChE
4.4.3. Fluorooctan: synteza letalna
Fluorooctan sodu jest stosowany jako silnie toksyczny pestycyd do zwalczania gryzoni (rodentycydy Ciekawe, że związek ten badany w izolowanych (w vitro) układach enzymatycznych wydawał się nieaktywny. Staje się on jednak silnym inhibitorem po aktywacji metabolicznej i hamuje reakcje zachodzące w cyklu Krebsa.
Normalnie, reszty dwuwęglowc (octan) po aktywacji do acetylokocnzy-mu A ulegają kondensacji ze szczawiooctancm. dając kwas cytrynowy. Kwas cytrynowy w dalszych przemianach musi najpierw przejść w m-akomtan, a następnie w kwas izocytrynowy (rys. 4.5).
Reakcja ta jest katalizowana przez enzym - akomtazę Podczas procesu tworzy się przejściowo kompleks cytrynian-akonitaza, a po odwodnieniu substratu następuje uwolnienie enzymu, co umożliwia jego dalszy udział w katalizie.
Fluorooctan zachowuje się analogicznie do octanu; przechodzi w formę aktywną (fluoroacetylo-CoA), w tej postaci ulega kondensacji ze szczawiooctancm do fluorocytrynianu i dalej tworzy kompleks z akomtazą. Kompleks ten mc ulega reakcji odwodnienia i jest trwały. Powoduje to przerwanie całego cyklu Krebsa, który jest podstawą przemian energetycznych komórki irys. 4.5).
94 4 MCCI IANIZMY DZIAŁANIA TOKSYCZNEGO
Wyszukiwarka
Podobne podstrony:
Pr złócc J**l red pruł dr lubJ K. PtirownlcKgo"Podstawy tuksyfculągii*. K«r«.r*i 3006. ISBN
Pr złócc J**l red pruł dr lubJ K. PtirownlcKgo"Podstawy toksybuk^i*. K ;«r»xr«j 3006. ISBN
Pr złócc J**l red pruł dr lubJ K. PtirownlcKgo"Podstawy toksybuk^i*. K ;«r»xr«j 3006. ISBN
Pr złócc J**l red pruł dr lubJ K. PtirownlcKgo"Pudom loknbuk^i*. K«r«.r*i 2006. ISBN
Pr złócc J**l red pruł dr lubJ K. Piuourokicgo"Podstawy toksybuk^i*. K«r«.r*i 3006. ISBN
Pr złócc J**l red pruł dr lubJ K. Pbcnwnlckgo"Podstawy tuksyfculągii*. K«r«.r*i 2006. ISBN
więcej podobnych podstron