Image8 (44)

20 Rozwiązania zadań ze zbioru "MENDLA
iłiY
k-T p•V 1
n°= ~~y~ = k - T v
Po skróceniu
no =
__P_
J= Nm
. Pa nf N 1 1
ln°]" J ~ N-m~ rr?'N.m-K'
n0 =-4?--= 0,0019907 -1028 = 2 • 10254r
1,38 • 10~23 - 546 n?
Odp.: W 1m3 znajduje się około 2 1025 cząsteczek gazu.
Zadanie 548 str.108
Szukane:
p = ?
Dane:
R = 8,31t-J — . kg • mol
m = 16g = 0,016 kg t = 10°C
V = 10dn? = 10 • (0,1 m)3 = 0,01 m3
m = 32-^-. = 0,032-^-. mol mol
Korzystamy z równania Clapeyrona w postaci:
p. V = -.R-T
P =
m- R T
H-V ’
/: V ale
T = t + 273K
m • R • (t + 273) stąd p =--^7 y
Jednostki
[P] =
kg • —■ K y mol__
kg 3 m
kg -J mol
kg • m mol moi
Po skróceniu otrzymamy:
J N ■ m „
—x = —r- = Pa
nr
_ 0,016 • 8,31 • 283 _ 37,6 P" 0,032 - 0,01 “0,00032
= 117586,5Pa
p = 118kPa
Odp.: Ciśnienie tlenu wynosi 118kPa.
Zadanie 549 str.110
Dane:
p = 2-105Pa
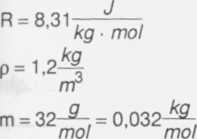
Szukane:
t = ?
Korzystamy z równania stanu gazu doskonałego (równanie Clapeyrona) w postaci:

p . V = n • R • T/: (n • R) n • R
Z definicji gęstości:
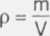
m = p • V /: p
V = — , gdzie
P
V - objętość gazu p - jego gęstość Po podstawieniu:
Masa gazu jest równa masie molowej pomnożonej przez liczbę moli: m = n • p
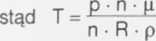
Po skróceniu T =
Rp
Wyszukiwarka
Podobne podstrony:
14750 Image8 (42) 106_Rozwiązania zadań ze zbioru "MENDLA " Objętość gazu jest wprost prop
Image8 (43) 70 Rozwiązania zadań ze zbioru "MENDLA " Ap = Pn • (mą - rrn) P v _ 100000Pa ■
Image7 (44) 18 Rozwiązania zadań ze zbioru "MENDLA dśr= Ą] 1,38- 10~23-(57+ 273) _ ^/l,38 10~23
Image20 (31) 44 Rozwiązania zadań ze zbioru "MENDLA " Stąd p-V = — • R • Ti /■ R • Ti T2 =
Image22 (28) 133 Rozwiązania zadań ze zbioru "MENDLAZadanie 636 str.128 Dane: mi = 20 kg m2 = 0
Image41 (20) 169_Rozwiązania zadań ze zbioru "MENDLA"___ Objętość gazu zmieniła się propor
więcej podobnych podstron