Image41 (20)
169_Rozwiązania zadań ze zbioru "MENDLA"___
Objętość gazu zmieniła się proporcjonalnie do jego temperatury, więc gaz poddano przemianie izobarycznej p = const, a więc mamy zależność:
Vi_V2
Ti “T2
Vi • T2 = V2 • Ti /: Ti
stąd V2 =
V1 • T2 Ti
Z wyrażenia na pracę gazu otrzymamy
W = — p • AV, gdzie AV = (V2-Vi) skąd W = - po • (V2 - V1)
... Vi • T2 w
W = - p0 • (—--Vi)
Vl.T2-ViTK
W = - Po •-^-)
i p = po
W = — po
Ti
Vi • (T2-Ti)
Pa--tL
Pa~n?
_______ ___(450 K- 300 K)
W = - 200000 Pa • 0,01 rrf •1-2
N ■ m= J
W = - 1000 J = -1 kJ- minus oznacza, że pracę wykonał gaz (układ).
Odp.: Gaz wykonał pracę 1 kJ.
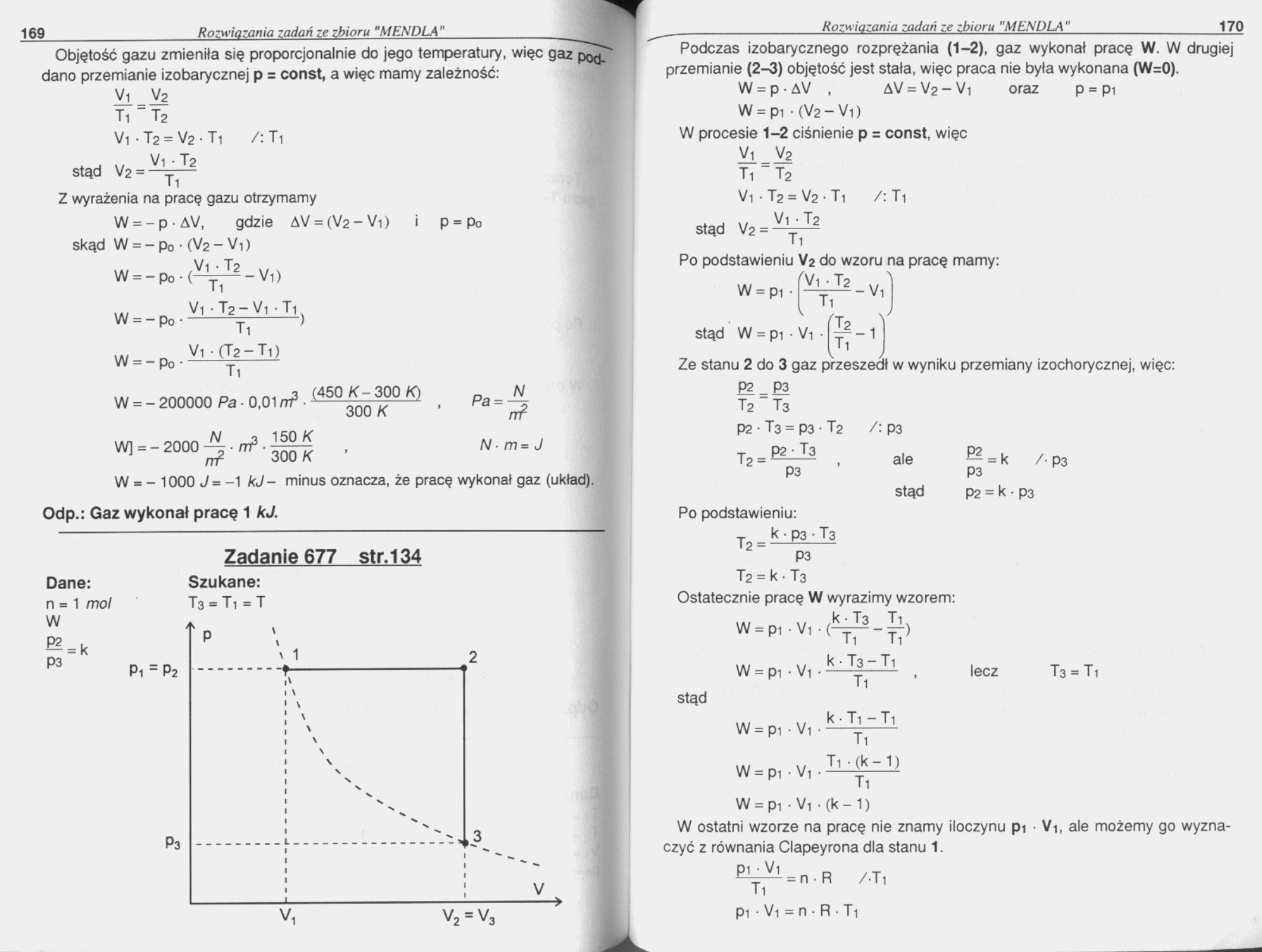
Zadanie 677 str.134
Dane:
n = 1 mol W
*-k
P3
Szukane:
T3 = Ti = T
Pi ~ P2
P3
|
P \ |
1 |
2 |
|
P 1 \ \ \ \ \ \ \ \ \ V X V V |
.3 | |
|
-----^ / / / / / < ' / |
v2 = v3
V,
Podczas izobarycznego rozprężania (1-2), gaz wykonał pracę W. W drugiej przemianie (2-3) objętość jest stała, więc praca nie była wykonana (W=0).
W = p • AV , AV = V2- Vi oraz p = pi
W = pi • (V2-V1)
W procesie 1-2 ciśnienie p = const, więc Yi_V2 Ti _T2
Vi • T2 = V2 • Ti /: Ti
stąd V2-^
Ti
Po podstawieniu V2 do wzoru na pracę mamy:
W = pi
Ti
/V1*T2V
stąd W = pi • Vi
Ze stanu 2 do 3 gaz przeszedł w wyniku przemiany izochorycznej, więc: P2 P3
T2 Ta
|
P2 • T3 = p3 • T2 |
/: P3 | |
|
ale |
e?=k | |
|
P3 |
P3 | |
|
stąd |
P2 = k • p3 |
/• P3
Po podstawieniu:
T2 =
k • P3 • Tą P3
T2 = k • T3
Ostatecznie pracę W wyrazimy wzorem:
... .. k-T3 Ti
w = p,-v,.(—-^1
stąd
W = pi • Vi
W = pi • Vi W = pi • Vi
k • Tą - Ti Ti ”
k-Ti-Ti
Ti
Ti • (k - 1)
lecz
T3 = Ti
W = pi • Vi • (k - 1)
= n • R /-Ti
W ostatni wzorze na pracę nie znamy iloczynu pi • Vi, ale możemy go wyznaczyć z równania Clapeyrona dla stanu 1. pi • Vi Ti
pi • Vi = n • R • Ti
Wyszukiwarka
Podobne podstrony:
14750 Image8 (42) 106_Rozwiązania zadań ze zbioru "MENDLA " Objętość gazu jest wprost prop
Image4 (62) 62 Rozwiązania zadań ze zbioru "MENDLA"_ Z równania gazu doskonałego dla stanó
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
69485 Image43 (19) 173 Rozwiązania zadań ze zbioru "MENDLA " k = n • R • T n- R T-W Odp.:
Image42 (19) 171 Rozwiązania zadań ze zbioru "MENDLA” Za pi • Vi do pracy W podstawimy n R • Ti
Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru "ME
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image48 (15) 183____Rozwiązania zadań ze zbioru "MENDLA"_ W przemianie B-C praca W2 = O, w
Image49 (16) 185 Rozwiązania zadań ze zbioru "MENDLA" Q - K P • AV K - 1 1,4 • 200000 Pa •
więcej podobnych podstron