Obraz'4 (3)
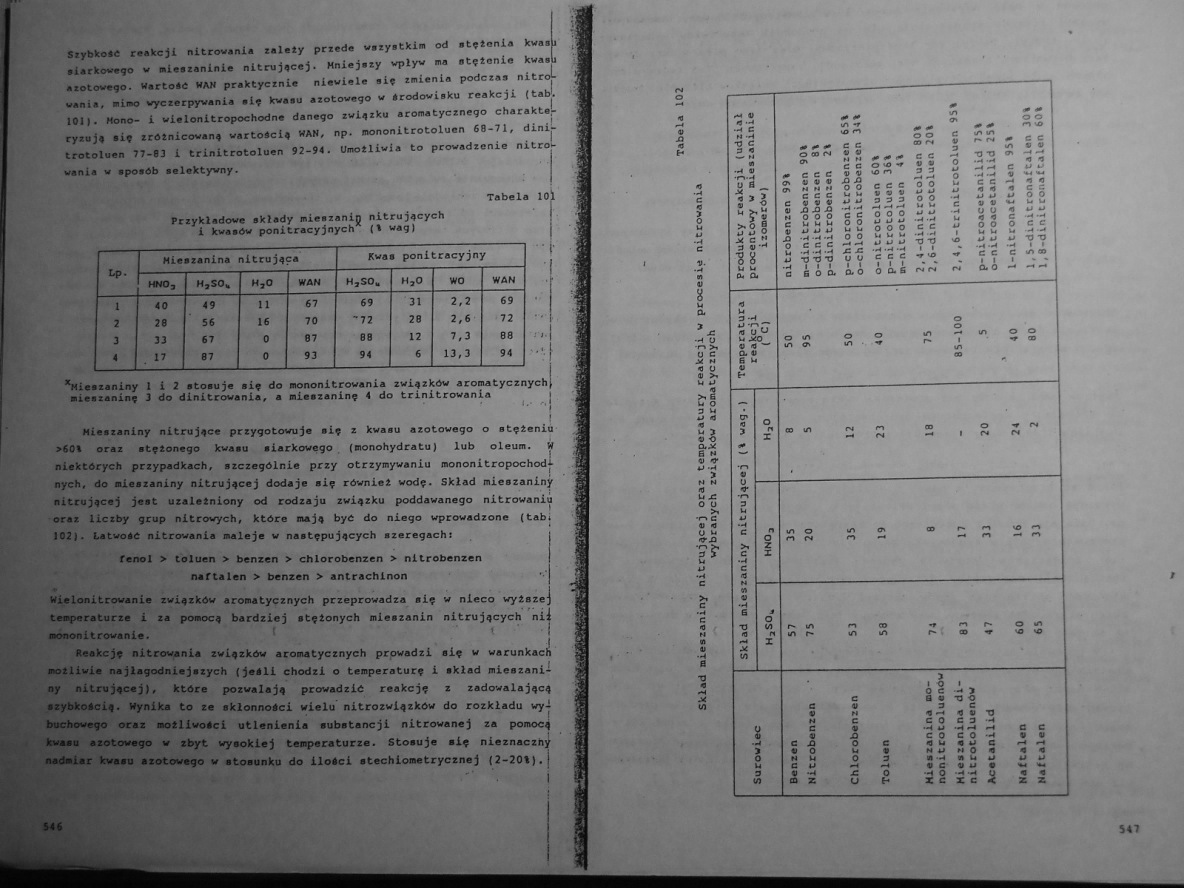
Szybkość reakcji nitrowania zaloty przede wazyetkin od stftania kwasi siarkowego w mieszaninie nitrującej. Mniejazy wpływ na et«tonie kwasi Męt owego. Wartość HAN praktycznie niewiele alf zmienia podczas nitrowania, mino wyczerpywania alf kwaau azotowego w środowisku reakcji (tab. 101|. Mono- i wielonitropochodne danego związku aromatycznego charakte-ryzujf się zróżnicowaną wartością HAN, np. nononitrotoluen 68-71, dini-trotoluen 77-83 i trinitrotoluen 92-94. Umożliwia to prowadzenie nitroL wania w sposób selektywny.
Tabela 101
Przykładowe składy mieszanin nitrujących i kwasów ponitrącyjnych (% wag)
|
Lp. |
Mieszanina |
nitrująca |
Kwas ponitracyjny | |||||
|
M40, |
M,SO* |
HjO |
WAN |
H,SO. |
M,0 |
wo |
WAN | |
|
1 |
40 |
49 |
11 |
67 |
69 |
31 |
2,2 |
69 |
|
2 |
28 |
56 |
16 |
70 |
-72 |
28 |
2,6 |
72 |
|
3 |
33 |
67 |
0 |
87 |
88 |
12 |
88 | |
|
4 |
‘.V17 |
87 |
0 |
“ |
94 |
6 |
13,3 |
94 |
*Mieazaniny 1 i 2 stosuje sif do mononitrowania związków aromatycznych} mieszaninę 3 do dinitrowania, a mieszaninę 4 do trinitrowania
■
Mieszaniny nitrujące przygotowuje się z kwasu azotowego o stężeniu >60% oraz stężonego kwasu siarkowego . (monohydratu) lub oleum. W niektórych przypadkach, szczególnie przy otrzymywaniu mononitropochod| nych. do mieszaniny nitrującej dodaje się również wodę. Skład mieszaniny nitrującej jest uzależniony od rodzaju związku poddawanego nitrowaniu oraz liczby grup nitrowych, które mają być do niego wprowadzone (tabi 102). Łatwość nitrowania naleje w następujących szeregach!
fenol > toluen > benzen > chlorobenzen > nitrobenzen naftalen > benzen > antrachinon
Wislonitrowanie związków aromatycznych przeprowadza się w nieco wyższe; t#*P*raturze i *■ pomocą bardziej stężonych mieszanin nitrujących nil mononitrowania.
Reakcję nitrowania związków arosiatycznych pręwadzi się w warunkach możliwie najłagodniejszych (jeśli chodzi o temperaturę i skład mieszaniny nitrującej), które pozwalają prowadzić reakcję z zadowalającą szybkością. Wynika to ze skłonności wielu nitrozwiązków do rozkładu wyi buchowego oraz możliwości utlenienia substancji nitrowanej za pomocą kwasu azotowego w zbyt wysokiej temperaturze. Stosuje się nieznaczny nadmiar kwasu azotowego w stosunku do ilości stechiometrycznej (2-20%).|
Skład mieszaniny nitrującej oraz temperatury reakcji w procesie nitrowania
wybranych związków aromatycznych
|
<- e |
te te | |||
|
•3 c N -4 |
iA *r Uł »■» | |||
|
V c 9 U —> N a -4 O o 1 |
te |
* " O CO 4*4 O ccc |
c c u e N te c c * u |
te te o e e a |
|
0 fi _ |
m o* |
u u e N N te |
A A O O |
e c |
u
b
9-4
W MO CU o. e fi w
£
c e o o u u o o —« —« r -c u u ao
9 9 -* —• O O W w O O u w
c c
I I a fi
o o
<0 «N
e e e e
9 9 -4
o o
w U
o o
w w w w ••4 -4 c e
• -4
T «0
o o «■» e
I* tn f— N
■O TJ
l«N # CC
u u
e e c ć
0 o te te W w
••4 —4
c e •4 •«* ”0 -O
1 i •A CO
m o •n w
m o»
r» m in r-
lA
O
o*
* e e
c
c 2 e o n te a u
S t
c
2
o
te
O
c o
—4 W
e o e w N W e-te
e c-
n
z c
547
Wyszukiwarka
Podobne podstrony:
Szybkość reakcji katalizowanej kontaktowo NIE zależy od: A. powierzchni
10587 Obraz (2015) 608 Reakcja sulfonowania jest odwracalna, w odróżnieniu od elektrofiJowego nitrow
IMG 121023 5015 Szybkość reakcji a Jej selektywność Łatwość odrywania atomów wodoru od węgli alkanu
IMAG0332 (4) 2: Stężenie substratu- przy stałym stężeniu enzymu szybkość reakcji prawie liniow o zal
IMAG0395 (2) i (29)=IS
IMAG0396 (2) I•K BI •*11 RYS 5. Zależność szybkości reakcji enzymatycznej od stężcnln substratu. >
Jeżeli reakcję przedstawimy równaniem:aA + bB h cC +dD to zależność szybkości reakcji od stężenia
ScannedImage 7 t Ryc. 8. zależność aktywności enzymu od pH Szybkość reakcji enzymatycznej rośnie wra
42667 Obraz (2600) 100 I 8.1. Zarys fenomenologicznej teorii szybkości reakcji przejścia j^Rozważmy
więcej podobnych podstron