Image25 (30)

1
54
Rozwiązania zadań ze zbioru "MENDLA"
P1 =P2 = P
Temperatury obu gazów również są identyczne: Ti = T2 = T
Z równania Clapeyrona dla wodoru otrzymamy:
p-Vi mi
T
p • Vi = V1 =
R AT
mi • R • T
Pi
mi • R • T
/: p
P1 • P
Podobnie dla azotu otrzymujemy: rri2 • R • T
V2 =
H2 • p
Teraz stosunek objętości wodoru Vi do objętości naczynia możemy zapisać w postaci:
Vi Vi V
stąd
mi • R • T m2 • R • T
+
P1 • P P2 • P Przekształcamy otrzymaną zależność: mi • R • T Vi V
m • p
V1
V
mi • R • T • [12 + m2 • R • T • pi P1 • H2 • p
mi • R • T _pi • P2 • p
|A1 • P Ostatecznie mamy:
Vi__mi • p2
V “
R • T • (mi • ^2 + m2 • m)
mi • p2 + m2 • pi
SL
V
3g ■ 28
mol
84
mol
84
A
mol
84
= 0,7
t
Rozwiązania zadań ze zbioru "MENDLA
55
Zadanie 572 str.114
Dane: Szukane:
tl = 47°C, ale Ti = 273K+ 47/<= 320K h = ?
I s 76 cm = 0,0760 m
t3 = - 33°C, więc T2 = 273K- 33K = 240K
pA = 1000hPa =» 760 mHg- co odpowiada ciśnieniu
hydrostatycznemu rtęci: pa = p g I
0 = 13600-— - gęstość rtęci
K nr
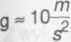


t2
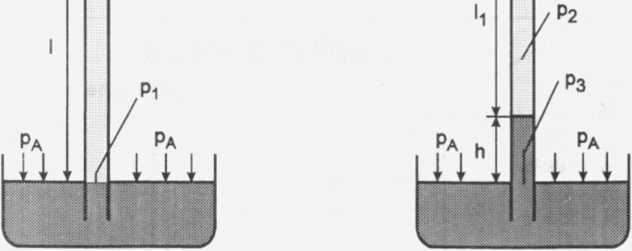
Z własności naczyń połączonych wiadomo,że ciśnienie cieczy na tym samym poziomie w różnych ramionach jest takie samo, więc:
|
< D. II CL |
P3 = pa, lecz |
P3 = p2 + h • p • g |
|
stąd |
P2 + h • p • g = pA | |
|
ale pi = p • g • I |
cn Cl _C 1 < CL II a |
gdzie pa = p • g • I |
|
więc |
cn CL SI 1 cn CL II CM CL | |
|
p2 = p • g • (I - h) Z równania gazu doskonałego dla obu stanów gazu otrzymamy: | ||
|
Pi ■ Vi p2 ■ V2 Ti " T2 ’ |
ale Vi = S • I |
i V2 = S • (I - h) |
Po podstawieniu:
S - pole przekroju rurki
/: p • g • S
p • g • I • S • I _ p • g • (I - h) • S • (I - h) Ti T2
/•t2
j! _ (I ~ h)2 Ti T2
Wyszukiwarka
Podobne podstrony:
Image20 (30) 129 Rozwiązania zadań ze zbioru "MENDLA" 129 Rozwiązania zadań ze zbioru
Image20 (30) 129 Rozwiązania zadań ze zbioru "MENDLA" 129 Rozwiązania zadań ze zbioru
Image24 (30) 137 Rozwiązania zadań ze zbioru "MENDLA " Prędkość ui wyznaczymy z zasady zac
Image20 (30) 129 Rozwiązania zadań ze zbioru "MENDLA" 129 Rozwiązania zadań ze zbioru
29311 Image25 (29) 139 Rozwiązania zadań ze zbioru "MENDLA" 10000 rrł At = 8380 N ■ m kg-K
Image20 (31) 44 Rozwiązania zadań ze zbioru "MENDLA " Stąd p-V = — • R • Ti /■ R • Ti T2 =
Image23 (26) 135 Rozwiązania zadań ze zbioru "MENDLA 135 Rozwiązania zadań ze zbioru "MEND
Image22 (28) 133 Rozwiązania zadań ze zbioru "MENDLAZadanie 636 str.128 Dane: mi = 20 kg m2 = 0
więcej podobnych podstron