Image36 (16)

159
Rozwiązania zadań ze zbioru "MENDLA
0,209
Q =-
Q = 5112
J m2 mol • K
203000—
nr
8,3-7^—.
K ■ mol
J • J K • mol mol ■ K J
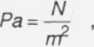
N-m = j
Q = 5,1 kJ
Odp.: Tlen pobrał 5,1 kJ ciepła.
Zadanie 665 str.132
Dane: Szukane:
Ati = 25°C = AT 1 = 25 AC . ^e = ?
—7 p = const. w
Qi = 500 J
At2 = -75 °C = AT2 = - 75 K
Q2 = -1070 J —^ V = const.
Z wyrażenia na ciepło molowe przy stałej objętości otrzymamy: Q
Cv n • AT Q2
Cv " n • AT2
Z wyrażenia na ciepło molowe przy stałym ciśnieniu mamy:
Q
Cp n • AT Qi
Cp “ n • ATi
Po podstawieniu otrzymamy:
Qi
cp n • ATi Cv _ Q2 n • aT2
cp Qi n • AT2 cv n • ATi Q2 c^ _ Qi AT2 cv AT 1 Q2 c^ _ Qi • AT2 cv Q2 • AT2

Rozwiązania zadań ze zbioru "MENDLA
160
Cp _ 500 J • ( - 75 K) Cv~ -1070 J ■ 25 K
Cr
Cv
1,4
Odp.: Stosunek ciepła molowego przy stałym ciśnieniu do ciepła molowego przy stałej objętości dla tlenku węgla wynosi 1,4.
Zadanie 666 str.132
Dane:
R = 8,31 ^ J . K ■ mol
n = 3 mole
AT = 80 K
k* 1,5
Szukane:
AU = ?
Zgodnie z I zasadą termodynamiki AU = Q + W
Zakładamy, że proces zachodzi w stałej objętości, więc praca W = 0, a ciepło molowe cv możemy wyrazić wzorem:
Q , . -r
Cv =-7^: /• n • AT
n • AT
stąd Q = cv • n • AT
Zmiana energii wewnętrznej przyjmie postać:
AU = cv • n • AT
Nie znamy cv, ale możemy je obliczyć z wykładnika adiabaty k.
Ponieważ k=^ /-cv Cv
stąd k • cv = cp , ale cp - cv = R
więc cp = R - Cv Po podstawieniu za cp mamy:
K • Cv — R + Cy K • Cy ~ CV = R
Cv • (K - 1) = R /: (K - 1)
stąd Cy = —R „
K - 1
Po podstawieniu do wyrażenia na zmianę energii wewnętrznej będzie:
AU =
_R_ k- 1
8,31
n • AT J
AU =
K ■ mol
1,5-1
■ 3 mole ■ 80 K
Wyszukiwarka
Podobne podstrony:
Image37 (17) 161 _Rozwiązania zadań ze zbioru "MENDLA AU = 16,62 ■ 240 4000 J
Image30 (23) 147 Rozwiązania zadań ze zbioru "MENDLA Dane: V = 5000 dm3 = 5 ni3Zadanie 648 str.
Image32 (23) 151 Rozwiązania zadań ze zbioru "MENDLA N ■ m = J 3 • 100000Pa • 1 rr? U = 150000-
Image34 (23) 155 Rozwiązania zadań ze zbioru "MENDLA ale Eśr = U = N • Eśr m • v§r stąd U = N 2
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image49 (16) 185 Rozwiązania zadań ze zbioru "MENDLA" Q - K P • AV K - 1 1,4 • 200000 Pa •
Image54 (16) 195 Rozwiązania zadań ze zbioru "MENDLA Ostatecznie pobrane ciepło jest równe: 195
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image50 (16) 187 Rozwiązania zadań ze zbioru "MENDLA" Objętość końcową V2 obliczymy korzys
Image52 (16) 191 Rozwiązania zadań ze zbioru "MENDLA Zadanie 692 str.138 Szukane: P2, Vi, V3 Da
więcej podobnych podstron