Image7 (43)

68 Rozwiązania zadań ze zbioru "MENDLA
Po podstawieniu:
V2 = S • (h + h2 - h3)
Znając pi ,p2 oraz Vi i V2 możemy je podstawić do wzoru na prawo przemiany adiabatycznej i otrzymamy:
(pi - P2) • S • h = (p4 - P3) • S • (h + h2 - h3) /: S • (h + h2 - h3)
P4 - P3 =
P4 = P3 +
(P1 - P2) • h • S (h + h2 - h3) • S h • (Pi ~ P2) h + h2 - h3
P4 = 734mmHg + ^~
y 80/71/77 + 748/77/77 - 734/77/77
A .. 80/77/77 • 20 mmHg
P4 = 734mmHg +-94mm
P4 * 734mmHg + 16 mmHg p4 = 750mmHg
Odp.: Rzeczywiste ciśnienie atmosferyczne wynosi 750 mmHg.
Zadanie 584 str.117
Dane: Szukane:
V = 2,5dn? = 0,0025/tt3* Ap = ?
ti = 0°C, czyli T = 273K mi =200 g= 0,2 kg rri2 = 201 gr = 0,201 0,2 kg
pn = 1013/iPa* 100000Pa
Stan początkowy balonu mg1
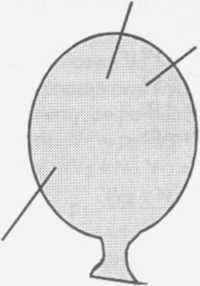
m1
Stan po doprowadzeniu gazu mg2
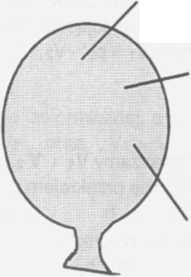
m2
Całkowita masa balonu mi składa się z masy gazu mgi i masy stałej mo . Podobnie rri2 = mg2 + mo —> rrig2 = rri2 - m0 mi = mgi + mo —> n^i = mi - mo
Z równania Clapeyrona dla stanu początkowego i końcowego gazu otrzymamy:
Pll_Y. _ EM . r /. 7
/: V
Stąd ciśnienie początkowe:
|i V
Podobnie ciśnienie po dopompowaniu gazu: mgi • R ■ T p- V
Ciśnienie w balonie zwiększy się o wartość:
Ap = p2 - pi
mg2-R-T mqi-R-T stąd Ap = ** ..— ~-y ..
p • V p • V
P2 =
R.T-dngz-mąi) ^ H ■ V
ale
oraz
m^ = m2 - mo rr^i = mi - m0
Po podstawieniu:
R ■ T • [m2 - mp - (mi - m0)] P-V
R ■ T • (m2 - mp - mi + m0)
Ap =
Ap = Ap =
p-V
R • T • (rr>2 - mi) p-V
Gaz w warunkach normalnych ma gęstość p, więc z równania Clapeyrona otrzymamy:
Prv V _ m R
T p p • pn • V = m • R • T m D T
^V'R* •
/• Tp
/: Pn • V
ale iloraz
m
= P
stąd p = p
R T
Pn
Po podstawieniu p do Ap i skróceniu otrzymamy: R • T • (rr»2 - mi)
Ap =
p • R • T
• V
Pn
Wyszukiwarka
Podobne podstrony:
Image8 (43) 70 Rozwiązania zadań ze zbioru "MENDLA " Ap = Pn • (mą - rrn) P v _ 100000Pa ■
Image7 (42) 104 Rozwiązania zadań ze zbioru "MENDLA" Przyrost ciśnienia gazu wynosi k proc
Image7 (44) 18 Rozwiązania zadań ze zbioru "MENDLA dśr= Ą] 1,38- 10~23-(57+ 273) _ ^/l,38 10~23
Image10 (43) 24 Rozwiązania zadań ze zbioru "MENDLA" n« 100 J- mol J~ n = 100 moli Odp.: W
35754 Image11 (43) 1 1 26 Rozwiązania zadań ze zbioru "MENDLA T = 302J■ * T = 302K Odp.: Temper
więcej podobnych podstron