img060 (14)

związków, jednakże wskutek braku powinowactwa do protonu nie hamują jego wędrówki między substancją rozpuszczoną a płynem miareczkującym, co pozwala na wykazanie nawet bardzo słabych właściwości kwasowych lub zasadowych substancji. Wadą tych rozpuszczalników jest stosunkowo słaba rozpuszczalność w nich wielu związków organicznych.
Do rozpuszczalników aprotolitycznych zalicza się większość nasyconych i aromatycznych węglowodorów oraz niektóre ich chlorowcopochodne. Przykładami tego typu rozpuszczalników mogą być: n-heksan, n-heptan, cykloheksan, chloroform, czterochlorek węgla, benzen, chlorobenzen itp. Wśród wymienionych najczęściej stosowanym rozpuszczalnikiem jest benzen. Znacznie rzadziej stosowane są toluen i ksylen.
Z chlorowanych aromatycznych węglowodorów najbardziej odpowiednim rozpuszczalnikiem jest chlorobenzen. Jego zdolność rozpuszczania związków jest większa niż benzenu, chociaż dużo mniejsza niż kwasu octowego. Jest to związane częściowo z jego momentem dipolowym, który występuje dzięki przeciwstawnemu efektowi mezomerycznemu pierścienia w stosunku do efektu indukcyjnego (—I) atomu chloru [37].
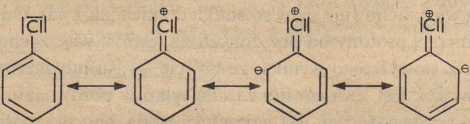
e
Rozpuszczalniki amfiprotolityczne
Biorą udział w reakcji uczestnicząc w wędrówce protonów. W zależności od powinowactwa do protonu podzielono je na dwie podgrupy: protonogenne i protonofilowe.
Rozpuszczalniki protonogenne (zwane też kwaśnymi). Wykazują małe powinowactwo do protonu, np. bezwodne kwasy: octowy, mrówkowy, propionowy, siarkowy, ciekły fluorowodór itp.
Im mniejsze jest powinowactwo rozpuszczalnika do protonu tym łatwiej oddaje on proton substancjom w nim rozpuszczonym, zwiększając ich charakter zasadowy, a zmniejszając kwasowy. W kwasie octowym aminy alifatyczne stają się więc zasadami mocnymi, natomiast chlorowodór jest kwasem słabszym niż w wodzie.
Kwas octowy 100% znalazł najszersze zastosowanie. Jest on bardzo dobrym rozpuszczalnikiem dla wielu związków organicznych i nieorganicznych; reaguje z zasadami w następujący sposób:
•3- K < L,
R—NH2 + CH3C00H R—NH3® + CH3COO©
Tak więc moc słabych zasad rozpuszczonych w kwasie octowym zostaje nie 1 tylko zwiększona w wyniku powstania mocniejszej zasady, jaką jest jon CH3COO~, ale także zniwelowana różnica mocy przez powstanie we wszystkich przypadkach
296
Wyszukiwarka
Podobne podstrony:
skanuj0009 (264) związków, jednakże wskutek braku powinowactwa do protonu nie hamują jego wędrówki m
jest to wydłużeniem czasu eluacji związku, który ma największe powinowactwo do fazy stacjonarnej w
IMAG0251 d. wszystkich wymienianych czynników A Kwasy żółciowe wykazują powinowactwo do: a. lip
6.3- Sądy miejskie W związku z wykupywaniem tbiedacaiych wójtostw doszło do zmian nie tyłko wrę wład
14 Karolina TARGOSZ Galileo rozsnuwał w liście do matki wszystkie atuty jego zaangażowania na służbę
ekologia21 i funkcjonalny (ryc. 14.18). jednak MMNIkiotny wzrost liczebności zwójki /mluknwal folę l
3 (321) 14 I. Edukacja wobec pracy i bezrobocia. Zaproszenie do społecznej debaty braku społecznej k
skanuj0014 (110) ig*SSI ierę. jest przej-Bkszość z nich rtaóre bakterie fca w stanie ich tae transpe
więcej podobnych podstron