Kwas zas1259

Jon wnilnrowy i pił Jf fl3fl

krew
5 20-
UJ
E
16J
CRr
|
Hh |
sSS& |
|
n i |
IHOOfl
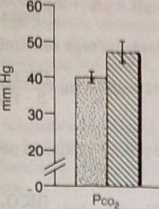
RYC. 34-1. Porównanie zależności pomiędzy pH, ciśnieniem cząstkowym CÓg (I\t>ł) uihh (HCOg1 we krwi tętniczej i płynie mózgowo-rdzeniowym (CSF) u zdrowych dorosłych ludzi. Pionowe kreski oznaczają £1 SD. (D.W. Seldin, G. Giebisch [red.]: Acid-base balance in specialited tissu&śl central nćiwus ayntem. W: The Regulation ofAcid-Base Balance. New York. Raven, 1989, 8.109).
niczą. Pęo CSF wynosi około 48 mm Hg, a Pco krwi tętniczo] około 40 mm Ha (zob. ryc. 34-1).2
2. Zaburzenia równowagi kwasowo-zasadowej można dokładnie scharakteryzować na podstawie danych dotyczących krwi; zmiany zewnątrzkomórkowc nic zawsze jednak odzwierciedlają zmiany wewnątrzkomórkowe. 'Ihkże zmiany równowagi kwasowo--zasadowej we krwi tętniczej mogą prowadzić do podobnych lub przeciwnych zmian w CSF w zależności od tego, czy zmiany [H*j we krwi si\ związane z zaburzeniami oddechowymi czy metabolicznymi.
a. Wzrost ciśnienia cząstkowego COa we krwi tętniczej (kwasica oddechowa) prowadzi do równoległego wzrostu ciśnienia cząstkowego CQa w CSF 1 powoduje zwiększenie [PT] zarówno we krwi tętniczej, jak i w CSF.
b. Obniżenie ciśnienia cząstkowego COa we krwi tętniczej (zozadowicfl oddechowa) prowadzi do równoległego obniżenia ciśnienia cząstkowego COa w CSF i powoduje zmniejszenie [H+] zarówno we krwi tętniczej, jak i w CSF.
c. Wzrost [H+] we krwi tętniczej (kwasica metaboliczna) pobudza wentylację, co prowadzi do zmniejszenia ciśnienia cząstkowego C08 we krwi tętniczą) oraz w CSF. Następuje alkaloza CSF i utrzymuje się zakwaszenie krwi.
d. Obniżenie [H+] we krwi tętniczej (zasadowicn metaboliczna) zmniejsza wentylację, co prowadzi do wzrostu ciśnienia cząstkowego COa we krwi tętniczej oraz w CSF. Następuje zakwaszenie CSF i utrzymuje się alkaloza krwi.
RÓWNANIE HENDERSONA-HASSELBALCHA
||§j Znaczenie. Równowaga kwasowo-zasadowa jest regulowana przez dwa narządy. Płuca regulują ciśnienie cząstkowe C02 przez zmiany wentylacji pęcherzykowej. 8 nerki kontrolują stężenie jonów HC03" [HC03*]. Klasyczny opis równowagi kwasowo-zasadowej podaje równanie Hendersona-Hasselbalcha, zawierające trzy zmnienne (pH, Pr oraz [HC03~]) i dwie stałe (pK’ i S).
Wyszukiwarka
Podobne podstrony:
88292 Kwas zas1257 Jon wodorowy i pH
Kwas zas1256 Rozdział 34 Jon wodorowy i pH CHEMICZNE (tab. 34-1). Jon H‘ jest protonem (tzn. atomem
29881 Kwas zas1252 W drugim etapie nerka musi zregenerować jon HC03~, który został zneutralizowany w
Kwas zas1253 Rozdział 33 _Metaboliczne źródło zasad AMINOKWASY ORAZ INNE JONY ORGA
Kwas zas1254 płyn zewnątrz- komórkowy Olutamlna _ "USt 1 a-KG® -1 2 HCOg ^ 2NHJ ♦ - -
więcej podobnych podstron