skan0041 (3)

44 Stany skupienia materii
2a:8. Butlę azotu o objętości 25 1 i ciśnieniu 2 atm podłączono do butli argonu o pojemności 50 1 i ciśnieniu 10 atm. Obliczyć ciśnienia cząstkowe oraz całkowite ciśnienie mieszaniny gazów po ich izotermicznym wymieszaniu. Odp.A-ałk = 7,33 atm.
2a:9. Gęstość pewnego gazu w temperaturze 0°C i pod ciśnieniem 0,3 atm wynosi 2,0587 • 10-3 g • cm-3. Obliczyć masę cząsteczkową tego gazu.
Odp. M= 153,8 g • mol-1.
2a:10. Wartości dtp dla C02 jako funkcja ciśnienia p w temperaturze 0°C wynoszą
|
p [atm] |
1,00 |
0,50 |
0,1 |
0,01 |
0,001 |
|
d!p [g • dni-3 • atm-1] |
1,9970 |
1,9702 |
1,9647 |
1,9635 |
1,9634 |
Obliczyć na tej podstawie masę cząsteczkową C02. Odp. 44,00 g • mol b 2b:l. Mając funkcję uwikłaną w postaci/(p, V, T) = 0, wykazać, że



2b:2. Wyprowadzić zależność
« / dp\
fi \ 377/
gdzie a oraz /? oznaczają odpowiednio izobaryczny współczynnik rozszerzalności cieplnej i izotermiczny współczynnik ściśliwości.
2b:3. Obliczyć współczynnik rozszerzalności termicznej a dla 1 mola: a) gazu idealnego, b) gazu Van der Waalsa. Odp.

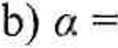
R
V{V-b)
1
RT _ 2a_ ' {V-bf V3
2b:4. Stałe a i b w równaniu Van der Waalsa dla etylenu wynoszą: a = = 4,47 • 106 cm6 • atm • mol-2, b = 57,1 cm3 • mol-1. Obliczyć objętość jednego mola etylenu w temperaturze 298 K i pod ciśnieniem 10 atm, stosując: a) równanie stanu gazu idealnego, b) równanie Yan der Waalsa. Odp. b) 2,314 • 10-3 m3 • mol-1.
2b:5. 1 mol ^-oktanu w temperaturze 400°C i pod ciśnieniem 1 atm (stan 1) sprężono do ciśnienia 20 atm (stan 2) i schłodzono pod tym ciśnieniem do 300°C (stan 3). Obliczyć objętość w tych stanach, stosując: a) równanie stanu
Wyszukiwarka
Podobne podstrony:
skan0021 (5) 24 Stany skupienia materii Przykład 2.3. Dla jednoatomowego gazu idealnego=
skan0043 (4) 46 Stany skupienia materii 2c:6. Ułamek cząsteczek gazu dNIN, o prędkościach pomiędzy u
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
skan0033 (3) 36 Stany skupienia materii średnia droga swobodna równa sięhi ~ gdzie Ar12 oznacza całk
43763 skan0037 (4) 40 Stany skupienia materii b) dla ciekłego CH3OH Par = (M,64 + 3 • 2,74 + 1 • 3,5
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
więcej podobnych podstron