skan0124

Roztwory i równowagi fazowe 127
Ułamek wagowy w, pomnożony przez 100 określa zawartość składnika i w procentach wagowych.
W elektrochemii i chemii analitycznej spotyka się jeszcze dość często stężenie normalne, n, określające liczbę gramorównoważników /-,• (vali) składnika 7 w jednostce objętości roztworu
n = -y- [val • dm-3]. (4.5)
Obowiązująca nas konwencja IUPAC zaleca zaniechania stosowania skali stężeń normalnych.
Stężenia molowe i normalne zależą od temperatury. Wzory (4.6) i (4.7) umożliwiają obliczenie ułamka molowego substancji rozpuszczonej przy znanej molalności m lub stężeniu molowym c. roztworu
*2 =
m
1000/Mi + m ’
(4.6)
cMx
ponadto
1000/? - cM2 + cMx ’ 1000mp
1000 + mM2
gdzie p oznacza gęstość roztworu:
m ] + m2
[mol • dm_i] = [M],
(4.7)
(4.8)
[kg • dm 3],
(4.9)
We wzorach (4.6)-(4.8) Mt ma wymiar [g • mol '], c - [mol • dm 3], zaś przelicznik 1000 - [g • kg-1].
Przykład 4.1. Roztwór zawierający 13,7 g NaOH w 92,0 g wody ma gęstość 1,1420 g • cm’3. Obliczyć: a) ułamki wagowe składników w, . b) ułamki molowe składników x„ c) stężenie molowe c, d) stężenie molalne m, e) stężenie normalne ??.
Rozwiązanie, a) Ułamki wagowe składników określa równanie (4.1)
tt’2
m2
ni] + ni 2
13,7
13,7 + 92
0,130;
Wj = 1 - w2 = 0,870.
b) Ułamki molowe składników określa równanie (4.2), gdzie
m2
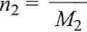
13,7
39,997
0,343
oraz
m
M
92
18,015
5,11.
Wyszukiwarka
Podobne podstrony:
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron