skan0136
Roztwory i równowagi fazowe 139
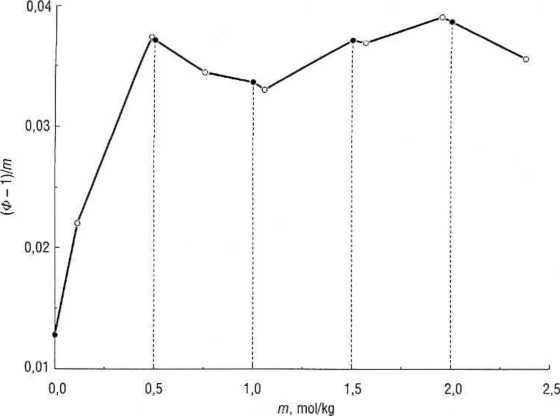
Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krioskopową
Jak widać z tab. 4.4, roztwory ^/-glukozy w wodzie wykazują niewielkie dodatnie odchylenia od właściwości roztworów idealnych. ■
Ciśnienie osmotyczne roztworu jest to ciśnienie zewnętrzne, niezbędne do zatrzymania samorzutnego przepływu rozpuszczalnika przez membranę półprze-puszczalną z czystego rozpuszczalnika do roztworu:
n = —j^r lnz?], (4.22)
gdzie V{ jest objętością molową czystego rozpuszczalnika, a{ zaś aktywnością rozpuszczalnika w roztworze. Dla roztworu idealnego równanie to przyjmie postać
(4.22a)
RT
n=-—r ln*!,
v\
a dla roztworu rozcieńczonego, gdzie lnx] = ln(l - x2) ~ -x2,
77= RT
x2
K
(4.23)
bądź
(4.24)
77= cRT.
Wyszukiwarka
Podobne podstrony:
skan0138 Roztwory i równowagi fazowe 141 Rys. 4.6. Dopasowanie wyników doświadczalnych metodą najmni
skan0158 (2) Roztwory i równowagi fazowe 161 Przy wyznaczaniu entalpii cząstkowych metodą graficzną
skan0162 (2) Roztwory i równowagi fazowe 165 Rys. 4.17. Równowaga ciecz-para dla układu benzen (B) -
52643 skan0146 Roztwory i równowagi fazowe 149 Rys. 4.10. Cząstkowe objętości molowe NaCl (V2) i H20
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
37877 skan0128 Roztwory i równowagi fazowe 131 a współczynnik podziału Nernsta wynosi 0,893. ■ [HA]/
28708 skan0156 Roztwory i równowagi fazowe 159 Podobnie jak poprzednio, wartość poehodnej możemy wyz
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
więcej podobnych podstron