28708 skan0156

Roztwory i równowagi fazowe 159
Podobnie jak poprzednio, wartość poehodnej możemy wyznaczyć graficznie lub analitycznie. W skali ułamków molowych punkty, przez które prowadzimy prostą w metodzie graficznej, są dość odległe od siebie, toteż, przy dużej krzywiźnie, nie jest ona zbyt dokładna (zob. tab. 4.10). Różnica między (7')graf i (7')anaiit wynosi prawie 9%, podczas gdy dla AHint -niespełna 1,2%. Dla niższych stężeń kwasu te różnice między obydwiema metodami wyznaczania entalpii cząstkowych będą mniejsze - wystarczy porównać wykresy A//int(Vw) i (jc2) na rys. 4.12 i 4.13.
Gdy roztwór złożony z n2 moli HN03 i n{ moli wody rozcieńczyć bardzo dużą ilością wody (zob. schemat 4.2), powstanie roztwór nieskończenie rozcieńczony, a z otoczeniem zostanie wymienione ciepło rozcieńczania &T:
h + n2<PT — n\Hi + n2H2,
gdzie h = n} Hx + n2H2 jest entalpią roztworu.
W tym równaniu bilansu cieplnego pominięto składnik °°H* (oznaczający entalpię nieskończenie dużej ilości wody), gdyż występuje on po obu stronach rówmości.
Zgodnie z definicją Hu z tego równania otrzymamy

Korzystając z zależności <PT(yjm), otrzymamy, postępując identycznie jak dla AHmi(s\m), molową cząstkową entalpię mieszania rozpuszczalnika:
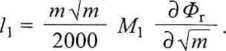
W ten sam sposób obliczamy H2:

a stąd l2\
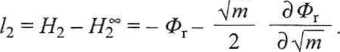
Zauważmy, że dla l2{AHmt) stanem odniesienia była czysta substancja rozpuszczona (H2), natomiast dla I2(0r) stanem odniesienia jest jej nieskończenie rozcieńczony roztw'ór {H2). W konsekwencji, z pomiarów ciepła rozcieńczania dostaniemy inną wartość l2 niż z pomiarów ciepła rozpuszczania AHint.
Wyszukiwarka
Podobne podstrony:
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
więcej podobnych podstron