skan0132
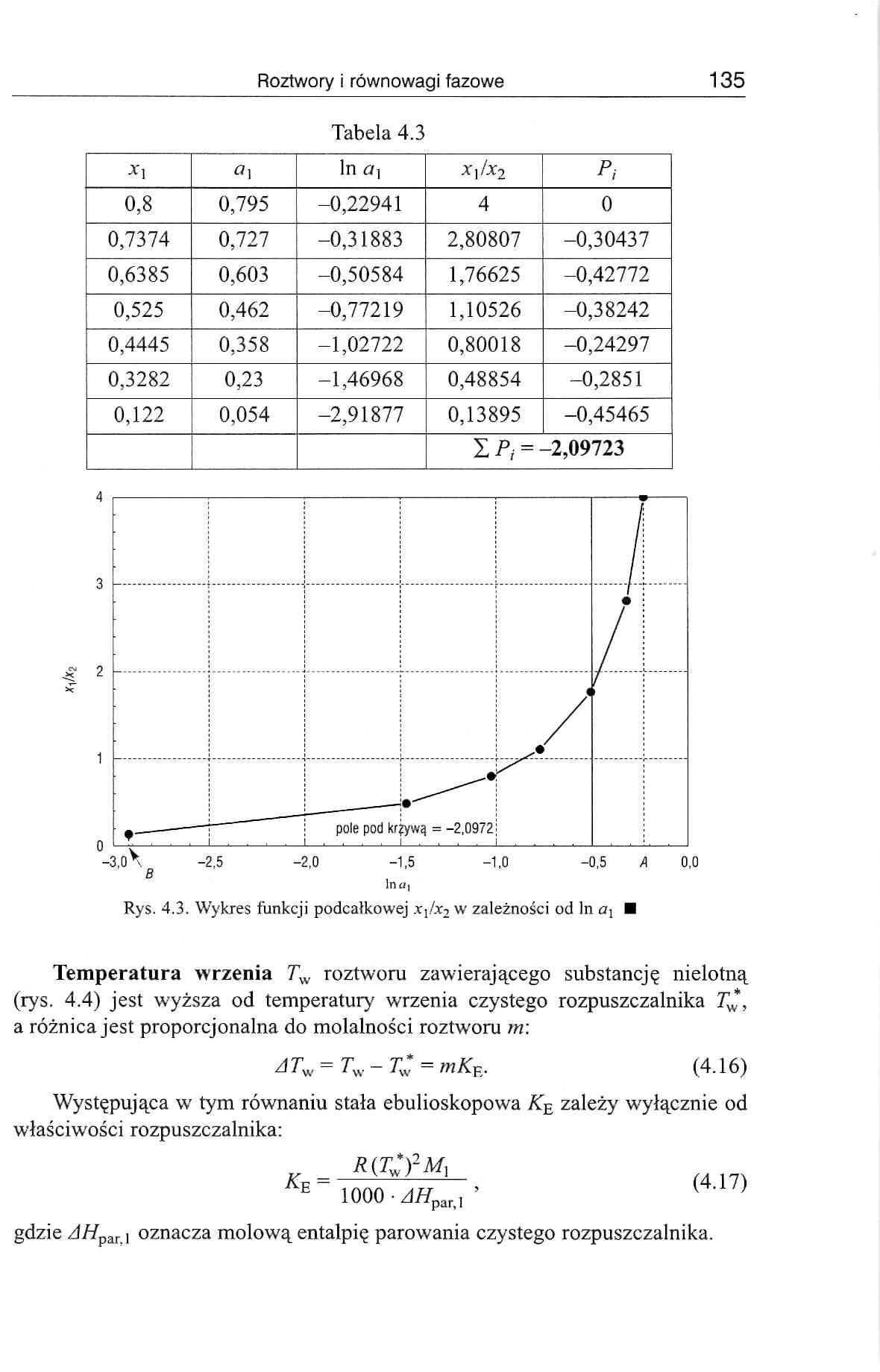
Roztwory i równowagi fazowe 135
Tabela 4.3
|
*1 |
a\ |
ln a\ |
X\/X2 |
Pi |
|
0,8 |
0,795 |
-0,22941 |
4 |
0 |
|
0,7374 |
0,727 |
-0,31883 |
2,80807 |
-0,30437 |
|
0,6385 |
0,603 |
-0,50584 |
1,76625 |
-0,42772 |
|
0,525 |
0,462 |
-0,77219 |
1,10526 |
-0,38242 |
|
0,4445 |
0,358 |
-1,02722 |
0,80018 |
-0,24297 |
|
0,3282 |
0,23 |
-1,46968 |
0,48854 |
-0,2851 |
|
0,122 |
0,054 |
-2,91877 |
0,13895 |
-0,45465 |
|
I Pi = -2,09723 | ||||
Temperatura wrzenia 7W roztworu zawierającego substancję nielotną (rys. 4.4) jest wyższa od temperatur)' wrzenia czystego rozpuszczalnika T a różnica jest proporcjonalna do molalności roztworu m:
(4.16)
AT„ = 72. - T* = mKf
Występująca w tym równaniu stała ebulioskopowa KE zależy wyłącznie od właściwości rozpuszczalnika:
(4.17)
*(Q2^i
1000 • AHpaT>] ’
gdzie AHpar ] oznacza molcwvą entalpię parowania czystego rozpuszczalnika.
Wyszukiwarka
Podobne podstrony:
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron