skan0323

326 Elektrochemia
stancja wyniosła 42,15 O. Graniczna przewodność molowa HCOOH wynosi 404,3 ■ 10-4 S • m2 • mol-1. Obliczyć termodynamiczną stałą dysocjacji kwasu mrówkowego w 25°C. Odp. K= 1,78 • 10-4.
6d:8. W temperaturze 25°C iloczyn rozpuszczalności AgCl wynosi 1,56 • 10~10. Obliczyć rozpuszczalność AgCl w roztworach NaN03 o stężeniach a) 0,000:
b) 0,001 M; c) 0,01 M. Odp. a) 1,80 • 10~3; b) 1,86 • 10"3; c) 2,01 • 10"3 g • dm"3'.
6d:9. Iloczyn rozpuszczalności MgF2 w temperaturze 25°C wynosi 7,0 • 10-9. Obliczyć rozpuszczalność MgF2: a) w czystej wodzie, b) w 0,01 M NaF.
c) w 0,01 M Mg(N03)2. Odp. a) 1,4 • 10"3 M; b) 1,3 • 10~4 M; c) 6,9 • 10”4 M.
6d:10. Obliczyć wf 25°C średni współczynnik aktywności MgCl2 w 0,1-mo-lalnym roztworze. Liczba solwatacyjna MgCl2 wynosi 6, aktywność wody zaś w tym roztworze 0,90. Odp. y± = 0,54.
6e:l. Dla poniższych elektrod napisać równania reakcji elektrodowych oraz rówmanie Nemsta na potencjał elektrody:
1. H+|H2 Pt
2. OH“|H2, Pt
3. 0H“|02, Pt
4. Cu2+|Cu
5. cr|ci2, Pt
6. CLIAgCl, Ag
7. Cl-|Hg2Cl2, Hg 8.S0MHg2S04, Hg
9. Ca2+|CaC204, PbC204, Pb 10. Na+|Na(Hg)
n.Tr, n3+|Pt
12. H+, chinon(Q), hydrochinon(H2Q)|Pt
13. H+|Sb203, Sb
14. Mn2+, Mn04 |Pt
15. H+, H202|Pt
Odp.
RT 4]^ l.E] = - In F
J'
2. E2 = E$ — ln a0H-
3 ,E3 = E3°-j^ ln
2F vo.
4.EĄ = E^-~\n — 2 F aCu2+
6 .E6 = Ei
7. E~j = E°
8. Es = E$
9. E9 = E$
RT
F
RT
F
RT
2 F
RT 2 F
ln acl-
ln acr
ln aS02-1
ln -
«Ca2+
5- E5
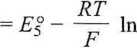
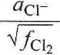
RT
10. £io = £?0 JF
aNa(Hg)
flNa+
Wyszukiwarka
Podobne podstrony:
A c gdzie c jest stężeniem elektrolitu Definiuje się także wartość graniczną przewodności molowej
12679 skan0320 Zadania 323 Wyznaczyć graniczną przewodność molową, A0 i stałą dysocjacji kwasu octow
P1050488 H PYTANIA KONTROLNE 93 23.10. Graniczne przewodnictwo molowe NH4CI wynosi 149,7 S-cm2 • mol
skan0321 324 Elektrochemia c [mol • m 3] 42 84 127 170 214 257 k [O-1
skan0305 308 Elektrochemia Przepływowi prądu elektrycznego przez granicę faz elektroda-roztwór towar
84546 skan0319 322 Elektrochemia 6b:7. Graniczne przewodności molowe Na2S04 w różnych temperaturach
Elektroniczny system odczytowy Wykład 6 15
s 71 9. SZEREG ELEKTROCHEMICZNY METALI. OGNIWA GALWANICZNE Na granicy faz, np. pomiędzy metalem a ro
skan0329 332 Elektrochemia AG298 = -350 kJ • mol’1; z1S = -51,14 + 0,4979F; AS29% = 97,23 J • K_1 •
więcej podobnych podstron