skanuj0199 (6)

2.23.2. Związki AB
W przypadku związków AB, utworzonych z dwóch rodzajów atomów, nie obserwuje się powstawania kryształów atomowych, w których charakter metaliczny A lub B byłby zbyt wyraźny, pomijając jedynie stopy, i w których różnica elektroujemności A i B byłaby zbyt duża, pomijając kryształy jonowe.
Spotyka się dwa ważne typy struktury. Powstają one w wyniku wzajemnego przenikania się dwóch sieci regularnych w pierwszym przypadku, heksagonalnych zaś w drugim.
W strukturze pierwszego typu atomy A i B zajmują położenia atomów grup A i B diamentu. Przykładem może być struktura blendy cynkowej (sfalerytu), jednej z dwóch odmian ZnS, o której była już mowa przy rozważaniu kryształów jonowych (s. 181). W przypadku innych związków o tej samej strukturze dominuje charakter kowalencyjny; są to mianowicie: BN (borazon), z którego inną odmianą spotkaliśmy się przy omawianiu kryształów jonowych, A1P, AlAs, SiC (odmiana /?), InP, InAs.
Strukturę drugiego typu można opisać jako splot dwóch sieci heksagonalnych, sieci atomów A i sieci atomów B. Podobnie jak w poprzednim typie każdy atom A lub B ma otoczenie tetraedryczne; liczba koordynacyjna wynosi 4. Grupą przestrzenną struktury tego typu jest P63mc.
Jako charakterystyczny przykład takiej struktury przytacza się często wurcyt, inną odmianę ZnS (rys. 2.55), chociaż zawiera on wiązania o charakterze głównie jonowym.

------4
|
o |
Zn w 0 i |
|
S w 3/8 | |
|
• |
Zn w 1/2 |
|
S w 7/8 |
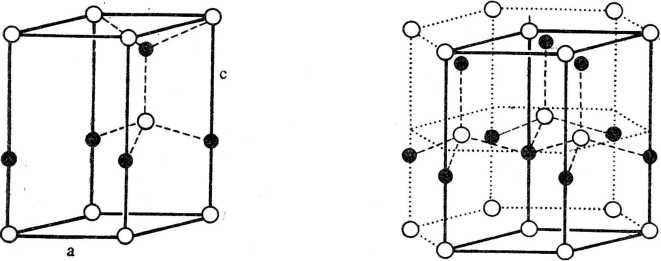
Rys. 2.55. Struktura wurcytu — komórka elementarna. Atomy wurcytu znajdują się w węzłach dwóch przeplatających się zwartych struktur heksagonalnych (O i •)
201
Wyszukiwarka
Podobne podstrony:
FAZY ZARZĄDZANIA WIEDZA -Faza chaosu - w przedsiębiorstwie nie obserwuje się związków między wiedzą
11331 SNB14084 nie obserwuje się np. w świecie zwierząt. W związku z tym faktem wysu. wają oni zasad
60065 skanuj0044 (62) Metody pomocy w przypadku dzieci z FAS - znacznie później. Dzieci z FAS często
skanuj0028 (43) stworzenie w Domu Opieki przyjaznej atmosfery, domowego ciepła. Sprawienie by nie st
skanuj0023 (49) 7.2. Typy ruchu turystycznego 173 Turystyka handlowa Innym rodzajem turystyki szerok
skanuj0037 (63) Wtozdział 10. Wybrane choroby alergiczne 203 r W okresie bezobjawowym zwykle nie stw
skanuj0007 (418) Z kolei system kształcenia specjalnego próbuje realizować zasadę integracji, która
skanuj0010 2 -obrzęk przedgoleniowy b) Niedoczynność tarczycy- objawy: . L noworodków nie obserwuje
skanuj0015(1) 2 sens mają Mamy do dyspozycji pięć zmysłów, których wciąż używamy nie zastanawiając s
więcej podobnych podstron