Image5 (56)

100 Rozwiązania zadań ze zbioru "MENDLA"
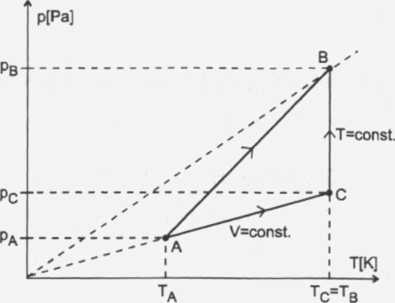
Na wykresie pokazano trzy izochory tej samej nasy gazu, więc z równaniąT'''' doskonałego mamy:
100 Rozwiązania zadań ze zbioru "MENDLA"
PA • Va Ta
PB • VB
Tb
Z rysunku odczytamy, że PB • Va _ PB • Vb Ta Tb Va Vb /t
Ta ~ Tb /Ta
Va = Vb • ^
Tb
Z wykresu odczytamy również zależność:
Ta <Tb/ : Tb Ta
skąd =- < 1, co oznacza,
i B
że również Va < Vb.
Z równania gazu dla stanów B i C otrzymamy: PB • Vb pc • Vc Tb " TC ’
Stąd po podstawieniu:
PB • Vb pc • Vc TC
stąd
Pa = Pb
/: Pb
lecz z wykresu mamy: Tb = Tc
Tc
PB • Vb = pc • Vc
/• Tc
/: PB
VB = VC■^
PB
Z wykresu widać, że Pb > pc /: Pb
np
stąd — < 1, co oznacza, że również zachodzi relacja: PB
Vb < Vc
Ostatecznie otrzymamy:
Va < Vb < Vc
Odp.: Najmniejszą objętość ma gaz w stanie A , a największą w stanie C.
Zadanie 609 str.122
Szukane:
Czy objętość gazu wzrosła, czy zmalała?
Gaz jest ogrzewany, więc kierunek procesu zaznaczony na rysunku (strona 101) jest zgodny z rzeczywistym od A —> B.
Zauważmy, że punkty A i B leżą na różnych izochorach (różne ciśnienia). Przejście ze stanu A do B można zrealizować po innej drodze. Najpierw ze stanu A do C przy stałej objętości, a następnie ze stanu C do B przy stałej temperaturze, ale przy wzroście ciśnienia od wartości pc do wartości Pb. Skoro przy wzroście ciśnienia temperatura jest stała, to znaczy, że objętość gazu musi się zmniejszyć.
Odp.: W naszym procesie objętość maleje.
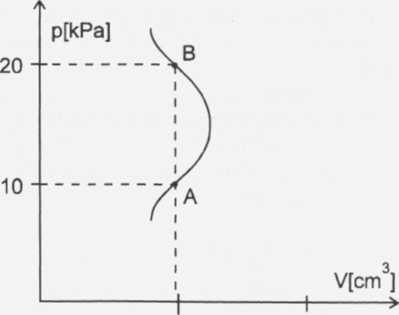
Zadanie 610 str.122
Dane: Szukane:
Ti = 300 K Tb = ?
Pa • Tb = pb-Ta /: pa
50
100
Z wykresu odczytujemy:
Pa = 1OkPa Pb = 20kPa
Ponieważ Va =Vb, więc gaz ze stanu A można przeprowadzić do stanu B izochorycznie, czyli zgodnie z prawem Charles^ mamy:
PĄ= PB Ta Tb
Tb =
PB • Tą
Pa
Wyszukiwarka
Podobne podstrony:
86768 Image16 (31) 36 Rozwiązania zadań ze zbioru "MENDLA" Na tłok działają trzy siły: N -
Image54 (16) 195 Rozwiązania zadań ze zbioru "MENDLA Ostatecznie pobrane ciepło jest równe: 195
Image56 (12) 199 Rozwiązania zadań ze zbioru "MENDLA" Sprawność silnika Carnota określona
Image5 (57) 90 Rozwiązania zadań ze zbioru "MENDLA Podobnie: T2 = Ti + AT Zgodnie z treścią zad
Image5 (58) 64 Rozwiązania zadań ze zbioru "MENDLA V1(T) V2(T) temperatura jest stała TT, 3T(Za
Image50 (16) 187 Rozwiązania zadań ze zbioru "MENDLA" Objętość końcową V2 obliczymy korzys
Image52 (16) 191 Rozwiązania zadań ze zbioru "MENDLA Zadanie 692 str.138 Szukane: P2, Vi, V3 Da
Image53 (14) 193 Rozwiązania zadań ze zbioru "MENDLA Dane: n = 1 mol Q = 6,16 kj= 6160 J t
Image5 (59) 14 _Rozwiązania zadań ze zbioru "MENDLA" Jednostki [ V ] = P
więcej podobnych podstron