S0024 (2)
■
I Soloktywncj tworzoriio wiązań węgiol
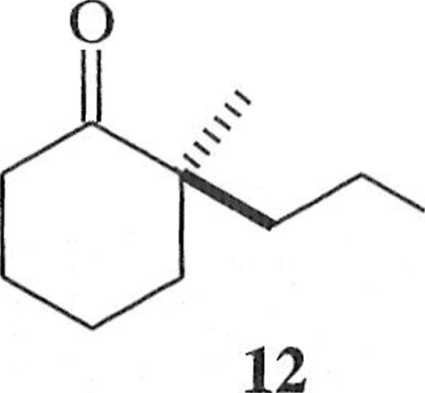
ceplorem zaś — akrylan mclylu (11). Produktem addycji jest optycznie czynny oksoester 12 (wyd. 81%, e.e. 91%) [19], który stanowi substrat do otrzymania optycznie czynnych y-butyrolaktonów 13 poprzez utlenianie Bayera-Villigera i iianslaktonizację [20], a także jest substratem do syntezy (+)-kassiolu (14)
(schemat 1.4.7) [21 [.
II
('()()Mc + 3
1. temp. pok., 4 dni 2. AcOH-H20
COOMe
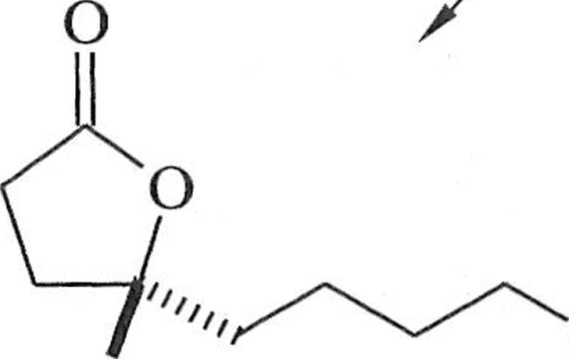
COOR
13
HO

OH

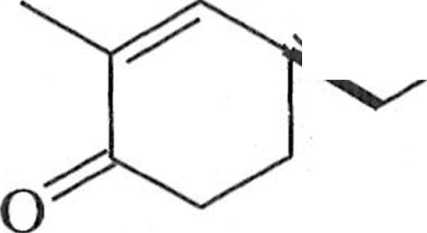
14
Schemat 1.4.7
Związek 12 może być traktowany jako produkt deracemizującego alkilowania wyjściowego 2-metylocykloheksanu (rac-1).
y • • . A. • y ^ , ,.,M ......

Część eksperymentalna
Addycja (S)-a-metylobenzyloaminy (2) do kwasu p-metoksy-frans-benzoiloakrylowego (8) (schemat 1.4.6) [19] 1
Diastereoselektywna synteza (I I -metylo-2-oksocyklo-
heksylo)propionianu metylu (12) (schemat 1.4.7) | lOa, 22|
i............ racemicznego 2-metylocykloheksanonu (0,56 g, 5 mmol) i (5)-«-n'L'
i l. >1 >■ nzylonminy (0,7 ml, 6 mmol) w toluenie (5 ml) dodaje się kwasu /Molucno nllonowego (40 mg) i całość ogrzewa do wrzenia z nasadką azeotropową prze/ 1 ...I my. Następnie do roztworu dodaje się bezwodnego K2C03 i miesza energia Mi' pi zez pól godziny. Węglan potasu odsącza się, przemywa toluenem i roztwm "l|Miowuje do sucha. Pozostałą iminę 3 oczyszcza się przez destylację próżniową I..1111ki do kolbki. Otrzymaną iminę 3 (0,64 g, 3 mmol) miesza się z akrylanem mi< lylu (0,26 g, 3 mmol) w atmosferze argonu przez 4 dni w temperaturze polu>
111 w i | Następnie dodaje się 90-procentowego kwasu octowego (2 ml) i mieś/-' mm kontynuuje jeszcze przez 1 godzinę. Mieszaninę reakcyjną rozcieńcza się * 11
11 m e il K
tyłowym (10 ml), ekstrahuje 1-molowym HC1, PI20 oraz 10-proccnlowym ()„ suszy MgS04 i odparowuje pod zmniejszonym ciśnieniem. Produkl * “ , „ \ . cza się przez chromatografię kolumnową na silikażelu, stosując jako ehie"1 .In lilmometan lub mieszaninę heksanu i octanu etylu. Wydajność produktu I*-. < ii nim etapie 0,4 g (67%), t.w. 70°C/0,01 mm Hg, [a\D22 +35,0 (c 1, lilOl •>• t| I rrl,," +37,0 (c 3, EtOH).
Literatura
I 11 Bergman, D. Gunsberg, R. Rappo, Org. React., 1959,10,179.
II A Umil, Org. Prep. Proced. Int., 1989,27, 705.
I ■ |Vrlmutter, ConjugateAddition Reactions in Organie Synthesis, Pergamon Press, Oxf(mI I’
I I > I ,itlle, M.R. Masjedizadeh, O. Walląuist, J.I. McLoughlin, Org. React., 1995, 47, 31 >.
II Kiatise, A. Hoffmann-Róder, Synthesis, 2001,171.
11 \ (>arc, C.H. Heathcock, Topics Stereochem., 1989,19, 227.
|| Ml I I
I
tl !/ IN |U
i < iawioński, K. Gawrońska, Stereo chemia w syntezie organicznej, PWN, Warszawa 1988 M r Sibi, S. Manyem, Tetrahedron, 2000,56, 8033. ji i Rossiter, N.M. Swingle, Chem. Rev., 1992, 92, 771.
11 Wynberg, Topics in Stereochemistry, 1986,16, 87.
,) N. Krause, Copper-Catalyzed Enantioselective Michael Additions. Recent Progress willi phosphorus Ligands w Organie Synthesis Highlights TV (red. H.-G. Schmalz), Wiley-V( II, W‘,,M I,, im M)()(), s. 182; b) A. Alexakis, C. Benhaim, Eur. J. Org. Chem., 2002, 3221.
11 i licmslra, H. Wynberg, J. Am. Chem. Soc., 1981,103, 417.
I (Juwioński, K. Gawrońska, H. Wynberg, J. Chem. Soc. Chem. Comm., 1981, 307. u i Poringa, ML Pineschi, L.A. Arnold, R. Imbos, A.H.M. De Vrics, Angew. Chem. Ini. 1997,36, 2620.
I k Myers, E.N. Jacobsen, ./. Am. Chem. Soc., 1999,121, 8959.
I luaiisli, J.L. Leon-Romo, A. Reyes, .1. liscalante, Tetrahedron: Asymmehy, 1999, /6, 244k l | (*t)nard, E. Diez-lkma, S. Merlno, Eur. 1. Org. Chem., 1998, 2051.
M Yamada, N. Nagashima. I I hiscgawti, S l akahashi, Tetrahedron Leli., 1998,39,9019,
,) M Plan, CJ. Revial, A ( bnnguiil l d Angt lo, J. Am. ('liem. Soi ., 1985, 107, 273; b) (i. ivt plan, Org. Synth., 1998. ( oll Ynl (,|o
)o energicznie mieszanego roztworu kwasu p-metoksy-trans-benzoiloakrylowego (185 mg, 0,9 mmol ) w 20 ml etanolu w temperaturze 40°C dodaje się (S)-a-metylo-henzyloaminy (0,23 ml, 1,0 mmol). Mieszanie kontynuuje się przez 16 godzin w temperaturze 40°C, a po oziębieniu bezbarwny osad odsącza się, przemywa litOII i suszy, otrzymując 210 mg (71%) (S,S)-9, t.t. 160-161°C (po krystalizacji z Met N bufor fosforanowy o pH 2,5 w stosunku objętościowym 1:1), [a]D20 +90,2 (<■ 0,05, McOll 0,05 inol/l I I2SC)4 w stosunku objętościowym 3:1), stosunek dia-slcieoizomerów 98,5:1,5.
Wyszukiwarka
Podobne podstrony:
S0043 (2) I Soloktywno Iworzonio wiązań węgiol wi.MjiciI + ML n [2 + 2] X X retro [2 + 2] (w następn
S0043 (2) I Soloktywno Iworzonio wiązań węgiol wi.MjiciI + ML n [2 + 2] X X retro [2 + 2] (w następn
S0043 (2) I Soloktywno Iworzonio wiązań węgiol wi.MjiciI + ML n [2 + 2] X X retro [2 + 2] (w następn
S0040 (2) I Soloktywno twor zonio wiązań węgiol wygml /. TJ. Wallów, B.M. Novak, ./. Org. Chan., 199
S0040 (2) I Soloktywno twor zonio wiązań węgiol wygml /. TJ. Wallów, B.M. Novak, ./. Org. Chan., 199
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
67497 S0045 (2) I. Soloktywne tworzenie wiązań węgiel węyiol o 3a c.h2ci2 Schemat 1.8.12 ( I + 3a lu
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
S0014 (2) I. Solni*.tywno tworzonie wiązań węgiel węgiel kontrola kinetyczna kontrola
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
więcej podobnych podstron