12417 IMG$15

Ze zmianą ciśnienia zmienia się wartość ciepła właściwego, jak to pokazano w tablicy 5 w przypadku powietrza dla różnych temperatur.
Tablica 5
Ciepło właściwe powietrza cp kcal/(kg ■ dog)
|
it |
ipjj |
60*0 |
120'C |
180°C |
240°C |
|
a |
0)2394 |
0,2416 |
0,2438 |
0,2460 |
0,2482 |
|
35 |
0,2463 |
0,2485 |
0,2507 |
0,2529 |
0,2551 |
|
90 |
0)2534 |
0,2556 |
0,2578 |
.0,2600 |
0,2622 |
|
100 |
0)2672 |
0,2694 |
0,2716 |
0,2738 |
0,2760 |
|
150 |
0,2797 |
0,2819 |
0,2841 |
0,2863 |
0,2885 |
|
300 |
0,2903 |
0)2925 |
0,2947 |
0,2969 |
0,2991 |
|
300 |
0,3002 |
0,3024 |
0,3046 |
0,3068 |
0,3090 |
Uwagi; Dla otrzymania wartości ciepła właściwego W kj/(kg • deg) należy pomnożyć Wartości w tablicy przez 4,1867 kj/kcal.
14. Średnie ciepło właściwe gazów. Ponieważ ciepło właściwe gazów rzeczywistych zależy nie tylko od temperatury, ale, szczególnie dla wielo-stomowych gazów, również od zakresu temperatury, w której gaz jest ogrzewany lub oziębiany, czyli że inną wartość ma ciepło właściwe gazu rzeczywistego przy ogrzewaniu go o 1°C w granicach od 100 do 101°C niż od 1000 do 1001°C, przyjęło się w technice pojęcie średniego ciepła właściwego dla danej temperatury
1 9 V kcal/(kg • deg) lub kJ/(kg - deg)
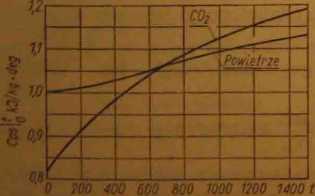
Ryt. 3-Średnie ciepło właściwe gazów
Przy zmniejszaniu się różnicy temperatur tj a tj, dążącej do 0, średnie ciepło właściwe staje się rzeczywistym ciepłem właściwym
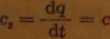
Średnią wartość ciepła właściwego niektórych gazów pi/y nikłym ciśnieniu podano w tablicy 6 i wykrcćlnie na rys. 3 w zakresie temperatur od 0°C do t°C.
Chcąc otrzymać z tej tablicy średnie ciepło właściwe w odniesienfu do 1 kg, należy odczytane z tablicy wartości podzielić przez rnaassj cząsteczkową '/< danego gazu.
T ikllii s
Średnic ciepło właściwe molowe niektórych gazów technicznych /icp w zakresie temperatur od 0 do (°0
|
fC |
Hz |
Nz |
Q* i |
GO |
H,0 |
COt |
SO, |
NH, |
Powie trze |
CH, |
|
w kcaf/(mol-deg) | ||||||||||
|
0 |
6,86 |
6,96 |
6,99 |
6,96 |
7,98 |
8,61 |
9,31 |
8,36 |
6,94 |
824 |
|
100 |
6,92 |
6,97 |
7,05 |
6,97 |
8,03 |
9,17 |
9,74 |
8,69 |
6,96 |
836 |
|
200 |
6,95 |
7,00 |
7,15 |
7,00 |
8,12 |
9,65 |
10,15 |
9,11 |
7,91 |
930 |
|
300 |
6,97 |
7,04 |
7,26 |
7,06 |
8,22 |
10,06 |
10,52 |
9,56 |
735 |
10,11 |
|
500 |
6,99 |
7,15, |
7,49 |
7,19 f |
8,47 |
10,75 |
11,11 |
1032 |
730 |
1131 |
|
1009 |
7,12 |
7,49 |
7,92 |
7,57 |
9,18 |
11,88 |
12,01 |
12,68 |
7,56 |
14,17 |
|
w kj/{mol-deg) | ||||||||||
|
0 |
28,62 |
29,12 |
29,27 |
29,12 |
33,50 |
35,86 |
38,85 |
34,98 |
29,07 |
34,74 |
|
100 |
28,94 |
29,14 |
29,54 |
29,18 |
33,74 |
38,11 |
40,65 |
36,30 |
29,15 |
3621 |
|
200 |
29,07 |
29,23 |
29,93 |
29^0 |
34,12 |
40,06 |
42,33 |
38,12 |
29,30 |
3933 |
|
300 |
29,12 |
29,38 |
30,40 |
29,52 - |
34,58 |
41,76 |
43,88 |
40,03 |
2932 |
4227 |
|
500 |
29,25 |
29,86 |
31,33 |
30,10 |
35,63 |
44,57 |
46,39 |
44,02 |
30,10 |
47,98 |
|
1000 |
29,79 |
31,31 |
33,12 |
31,67 |
38,62 |
49,39 |
10,16 |
53,05 |
31,60 |
6030 |
Przykład 13. Znaleźć stałą gazową mieszaniny Rm, pozorną masą molową- ifiSgj oraz gęstość ęm w warunkach normalnych, jeżeli układ objętościowy tej mieszaniny jest następujący:
H, = 0,485 CH4—Uj = 0,35 CjH»-U, | 0,0458
CO-Ut = 0,0718 COj—I 1 0,0182 0,-11,, i 0,0024
Ni -u- = 0,027
Mm = £ MuMn ~ 11,481 kg/nibl . 848 848
Rm =-i ——- i 73,8 kG • m/(kg • deg)
Mm 11,491
Mm' 11,401
em 1 -=-^——r- a 0,511 kg/m" (przy 0°C i 760mmHg)
Vm
Sposób obliczenia pozornej masy molowej i gęstości mieszaniny w układzie SI nie-ulega zmianie.
Stała gazowa mieszaniny wyniesie:
8315
Rm g-
Mm
8315
— 1 724 J/(kg ■ deg)
41
Wyszukiwarka
Podobne podstrony:
12417 IMG$15 Ze zmianą ciśnienia zmienia się wartość ciepła właściwego, jak to pokazano w tablicy 5
IMG$15 Ze zmianą ciśnienia zmienia się wartość ciepła właściwego, jak to pokazano w tablicy 5 w przy
Mili czytelnicy. Na wstępie mamy dla Was bardzo ważną wiadomość!!! W związku ze zmianą banku zmienił
Ściśliwość - przejawia się w zmianie objętości ze zmiana ciśnienia. Własność tą opisują dwa poniższe
VI. 17. MIESZKO CHOŚCISKO. 327 ze zmianą generacyj ciągle się powtarzających, a przez półtrzecia
VI. 17. MIESZKO CHOŚCISKO. 327 ze zmianą generacyj ciągle się powtarzających, a przez półtrzecia
IMG 00 (5) Definicje iyslcksjii rozwojowej* zmieniają się wraz z postępem nauki i wiedzy na temat ge
ska08 ną w hierarchii zmysłów (zapoczątkowaną przez bezpośredni związek druku ze zmysłem wzroku) zmi
fizjo 2 I Autoregulacja przepływu krwi przez nerki Jeżeli nerkę perfunduje się pod ciśnieniem zmieni
126 ///. Pragmatyzm łoby jednak tę wadę. że znaczenie zdania zmieniałoby się w zależności od chwili
126 III. Pragmatyzm łoby jolnak tę wadę. że znaczenie zdania zmieniałoby się w zależności od chwili
20101215�5 30 Stan rownowaut reakcji , + 3H: = 2NH t ze wzrostem ciśnienia. a Przesuw a się w lewo (
126 ///. Pragmatyzm łoby jednak tę wadę. że znaczenie zdania zmieniałoby się w zależności od chwili
więcej podobnych podstron