Image12 (39)

113
P2
Rozwiązania zadań ze zbioru "MENDLA
vi=V3 V

Rozwiązania zadań ze zbioru "MENDLA
114
T2= 500K
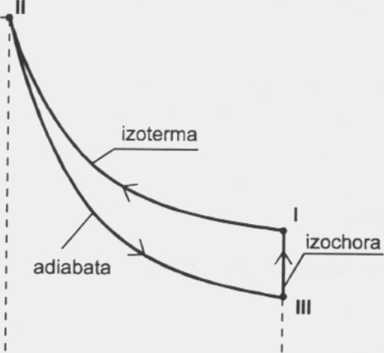
Ze stanu I do stanu II gaz jest przeprowadzony izotermicznie, więc:
T1 = T2 = 500K
Z równania Clapeyrona dla stanu trzeciego otrzymamy temperaturę T3.
^V- = n • R / • T3 13
p3 . V3 = n • R • T3 /: n ■ R
T3 =
P3 • V3 n- R
lecz
m
n = — P
a z wykresu mamy V3 = Vi = 0,01/rr3 po podstawieniu do T3 będzie:
P3 • Vi
T3 =
t3 =
Z równania Clapeyrona dla stanu drugiego otrzymamy:
V? = n • R /-T2 I 2
p2 • V2 = n • R • T2 /: (n • R)
P2 • V2
stąd T2 =
n ■ R
Ilość moli gazu n możemy obliczyć dzieląc masę gazu m przez masę jednego mola n tego gazu.
m
n =
Po podstawieniu do temperatury T2 mamy: P2 • V2
t2 =
T2 =
T2 =
— • R P
P2 • V2•P m • R
2,6 • 107 Pa ■ 0,005 m3 ■ 0,032-^-,
mol
1 kg 8,31
J
Pa- —
rrł
J= N-m
T3 =
T3 =
T3 = 385
N ■ m • kg K • mol
J= N ■ m
mol kg ■ N ■ m
T3 = 385AC
Ze stanu I do II gaz jest przeprowadzony izotermicznie, więc: Ti = T2 = 300K. Dla tej przemiany mamy:
pi • Vi = p2 • V2 /: Vi
Pi =
Pi =
P2 • V2 Vl
2,6 - 107 0,005 m3
K ■ mol
T2 =
0,000416-107Az-n?.^3-l rr? ™>l
8,31
kg • N ■ m K ■ mol
T2 = 500^m/(g. K'mo1 mol kg ■ N ■ m

0,01 m3 pi = 1,3 • 107Pa pi = 13-10 6Pa pi = 13 MPa
Odp.: Temperatura tlenu w kolejnych stanach wynosiła: 500K, 500K, 385/C. Ciśnienia dla stanu pierwszego: 13MPa, a objętość w stanie trzecim 0,01 m3.
Wyszukiwarka
Podobne podstrony:
Image13 (39) 30 Rozwiązania zadań ze zbioru "MENDLA" 30 Rozwiązania zadań ze zbioru
Image52 (16) 191 Rozwiązania zadań ze zbioru "MENDLA Zadanie 692 str.138 Szukane: P2, Vi, V3 Da
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
49379 Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Budow atom (13) Rozdział 2. Budowa atomów 27 Informacja do zadań 38. i 39. Kwantowanie energii elekt
CCF20081211�000 Zadania 113 Uwaga. W rozwiązaniu zadania nie występuje wynik pomiaru 2r«=30,0 mm. To
k3 (4) MIEJSCE KOPRENIKA W FILOZOFII 113 przestworzy”, i jedynie świadomość, że nic nie grozi duchow
PEDAGOGIA 113 potrzeby władzy, z drugiej - że nic może to odbywać się kosztem grup społecznych. Pańs
więcej podobnych podstron