56859 skan0129
132 Roztwory i równowagi fazowe
Do obliczenia współczynników aktywności należy skorzystać z wyrażenia (4.13)
a, = li-
Wyniki obliczeń zamieszczono w tab. 4.2.
Tabela 4.2
|
*2 |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
1 |
|
1 |
0,747 |
0,483 |
0,279 |
0,12 |
0 | |
|
}'l |
1 |
0,934 |
0,806 |
0,697 |
0,601 |
— |
|
a2 |
0 |
0,106 |
0,294 |
0,533 |
0,778 |
1 |
|
72 |
— |
0,529 |
0,734 |
0,889 |
0,972 |
1 |
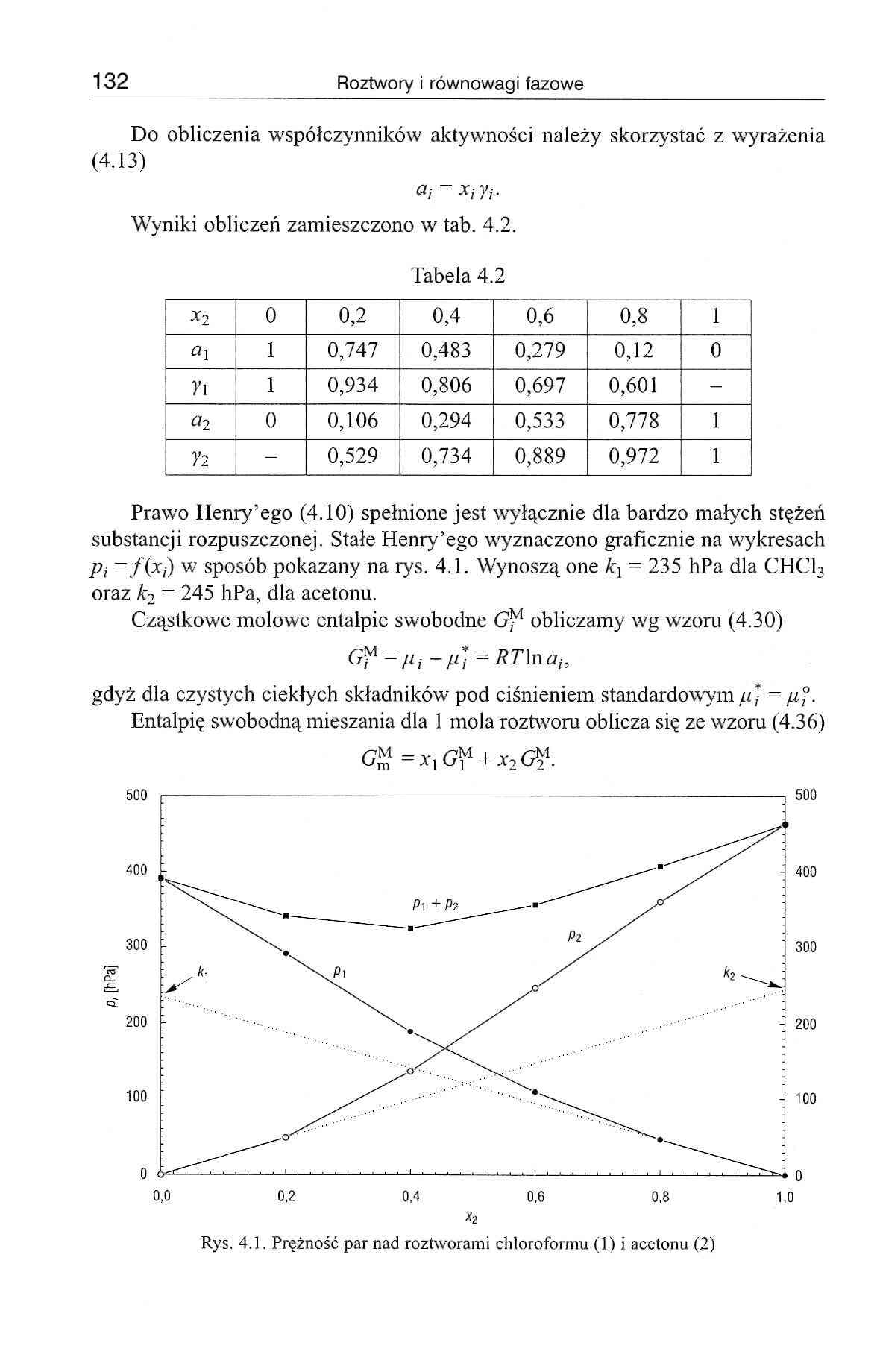
Prawo Henry’ego (4.10) spełnione jest wyłącznie dla bardzo małych stężeń substancji rozpuszczonej. Stałe Henry’ego wyznaczono graficznie na wykresach Pi =/(-x,) w sposób pokazany na rys. 4.1. Wynoszą one k] = 235 hPa dla CHC13 oraz k2 — 245 hPa, dla acetonu.
Cząstkowe molowe entalpie swobodne Gf1 obliczamy wg wzoru (4.30)
= ah
gdyż dla czystych ciekłych składników pod ciśnieniem standardowym fi* = //?. Entalpię swobodną mieszania dla 1 mola roztworu oblicza się ze wzoru (4.36)
G“ = .v, Gf + .v2

Rys. 4.1. Prężność par nad roztworami chloroformu (1) i acetonu (2)
Wyszukiwarka
Podobne podstrony:
skan0183 186 Roztwory i równowagi fazowe 4d:3. Obliczyć stężenie roztworu glukozy izotonicznego z ro
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0181 184 Roztwory i równowagi fazowe 4c:l. W 25°C prężność pary wodnej wynosi 23,76 mm Hg. Oblic
47266 skan0165 (2) 168 Roztwory i równowagi fazowe Można stąd określić graficznie bądź obliczyć z ró
skan0149 (2) 152 Roztwory i równowagi fazowe Entalpię nadmiarową IiE można obliczyć z równania I •
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
więcej podobnych podstron