skan0155
158 Roztwory i równowagi fazowe
Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
_ 13,877-V13,877_ . 18 015.4 569 = _2 13 kJ . mol-i 2000
i i 2 077
U = (-26,98) + —-- • 4,569 = -18,47 k.T • mol"1.
2
Dla porównania (F')anaiit = 4,515, stąd /, =-2,10 oraz l2 = -18,60 kJ • mol-1 (przyjmując wartość dHml obliczoną z równania aproksymacyjnego).
Molową entalpię mieszania obliczamy ze wzoru (4.28):
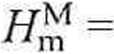
-X] l] + x2l2 ~ I-
o
-1
-2
-3
-5
-6
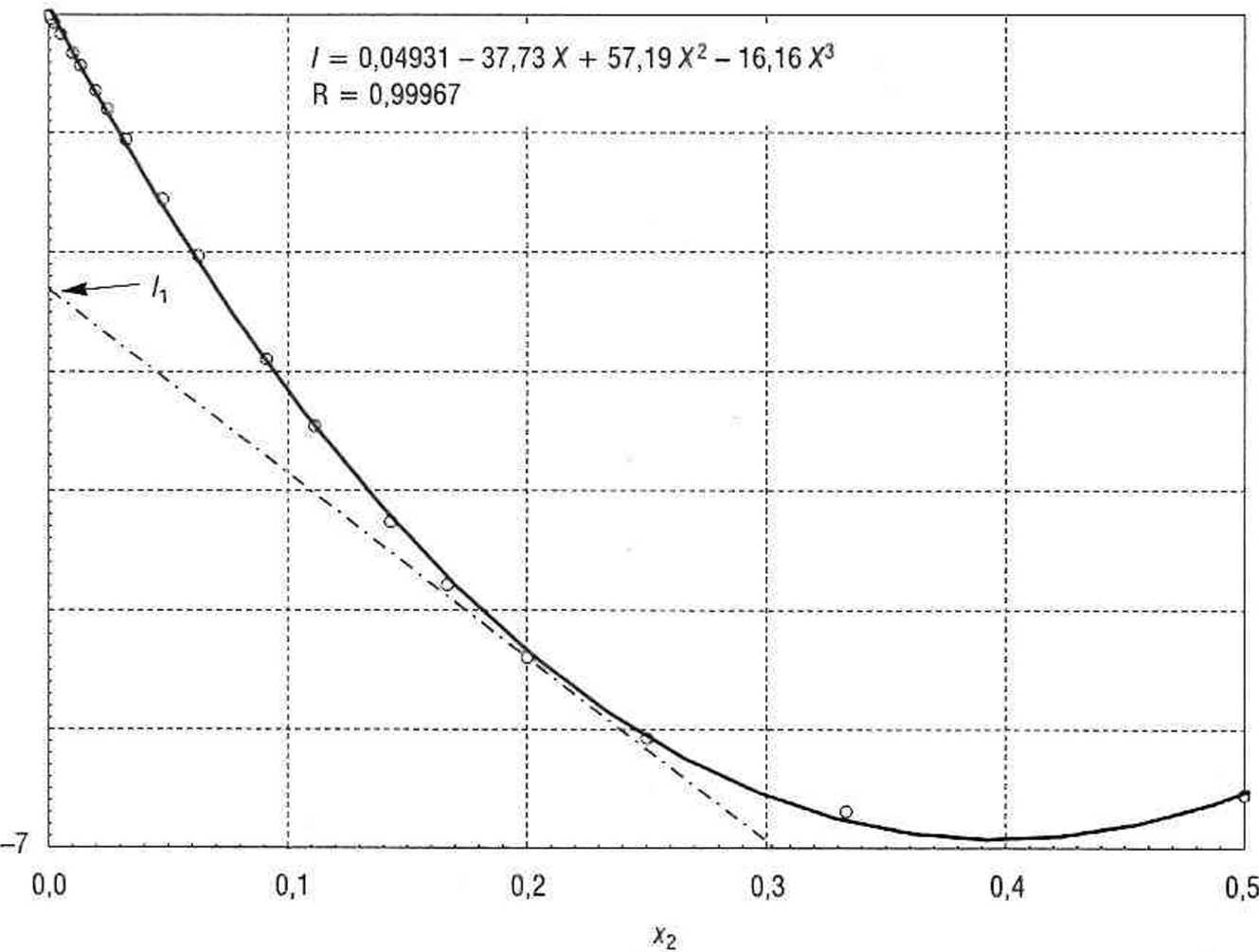
Rys. 4.13. Molowa entalpia mieszania (rozpuszczania) HN03 i wody w 25°C
njAH.jnt
n\ + n2
O
E
5
Podobne równanie mieliśmy już W' przykładzie 4.9. Powtarzając tamto postępowanie, otrzymamy
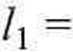
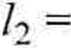
dn i
J»2
= / + (;?] + n2)
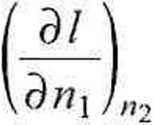
dl
~x2
ax2
3 (n2AHiM
dni
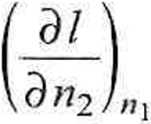
= l+(\-x2)
dl
dx2 5
Wyszukiwarka
Podobne podstrony:
85697 skan0191 194 Roztwory i równowagi fazowe temperatury i wynoszą, odpowiednio, 25,77 oraz 28,85
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0139 142 Roztwory i równowagi fazoweym = Y n + n2 - X] Yy + x2Y2. (4.28) Różniczkując (4.27) otr
skan0177 180 Roztwory i równowagi fazowe Hz0 (0) % wagowe N
skan0181 184 Roztwory i równowagi fazowe 4c:l. W 25°C prężność pary wodnej wynosi 23,76 mm Hg. Oblic
więcej podobnych podstron