skan0133

136 Roztwory i równowagi fazowe

Temperatura krzepnięcia roztworu Tk, zawierającego nielotną i nie rozpuszczającą się w stałym rozpuszczalniku substancję rozpuszczoną, jest niższa od temperatury krzepnięcia czystego rozpuszczalnika, Tk, a różnica jest proporcjonalna do molalności roztworu:
ATk = Tk*-Tk = mKK. (4.18)
W równaniu tym stała krioskopowa AfK zależy wyłącznie od właściwości rozpuszczalnika:
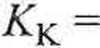
RjTCfM,
1000 • zf//topn i
(4.19)
gdzie zJ//topn ] oznacza molową entalpię topnienia czystego rozpuszczalnika. We wzorach (4.17) i (4.19) masa molowa rozpuszczalnika A/j jest w [g • mol-1].
W roztworach elektrolitów substancja rozpuszczona może dysocjować na v = v+ + v_ jonów ze stopniem dysocjacji 0 < a $ 1. W takich przypadkach do wzorów (4.16) i (4.18) wprowadza się współczynnik izotoniczny i (zwany też czynnikiem Van’t Hoffa), otrzymując
= imKE oraz ATk = imKK,
gdzie i = a (v - 1) + 1.
Przykład 4.6. Benzen krzepnie w 278,68 K, jego entalpia topnienia w tej temperaturze wynosi 126,1 J ■ g_I. Obliczyć temperaturę krzepnięcia roztworu kwasu benzoesowego w benzenie o stężeniu molalnym m = 0,065 mol ■ kg-1.
Wyszukiwarka
Podobne podstrony:
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
59488 skan0193 196 Roztwory i równowagi fazowe temperatura % molowe Rys. 4.33
85697 skan0191 194 Roztwory i równowagi fazowe temperatury i wynoszą, odpowiednio, 25,77 oraz 28,85
skan0175 178 Roztwory i równowagi fazowe Z tego względu ustala się tutaj zarówno temperaturę T, jak
skan0175 178 Roztwory i równowagi fazowe Z tego względu ustala się tutaj zarówno temperaturę T, jak
skan0175 178 Roztwory i równowagi fazowe Z tego względu ustala się tutaj zarówno temperaturę T, jak
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
więcej podobnych podstron